题目内容
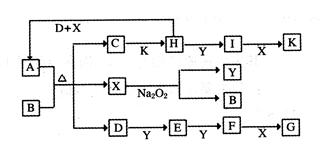
(16分)如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。

试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g)
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。(1) (2分)(2)NH3+SO2+H2O=NH4HSO3;(2分)
(2分)(2)NH3+SO2+H2O=NH4HSO3;(2分)
(3)SO32-+2H+=SO2↑+H2O(2分)
(4) (NH4)2SO4 (2分)
(5)2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1 (2分),80%;(2分)
2SO3(g) ΔH=-196.6 kJ·mol-1 (2分),80%;(2分)
(6)0.5(2分) ,1 (2分)
 (2分)(2)NH3+SO2+H2O=NH4HSO3;(2分)
(2分)(2)NH3+SO2+H2O=NH4HSO3;(2分)(3)SO32-+2H+=SO2↑+H2O(2分)
(4) (NH4)2SO4 (2分)
(5)2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ·mol-1 (2分),80%;(2分)
2SO3(g) ΔH=-196.6 kJ·mol-1 (2分),80%;(2分)(6)0.5(2分) ,1 (2分)
本题是无机框图题,关键是找准突破点。X为无色液体,则X应该是水,所以Y是氧气,B是氢氧化钠。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,说明H应该是是SO2。SO2具有还原性,被过氧化钠氧化生成硫酸钠,硫酸钠和钡离子反应生成硫酸钡白色沉淀。SO2被氧气氧化生成三氧化硫,三氧化硫溶于水生成硫酸,即I是三氧化硫,K是硫酸。一个D分子中含有10个电子,所以D可能是A氨气,则E是NO,F是NO2,所以G是硝酸。A是由短周期元素组成的酸式盐,所以A是亚硫酸氢铵,所以B是氢氧化钠,C是亚硫酸钠。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目


 (%)]随温度[T(℃)]的变化曲线。
(%)]随温度[T(℃)]的变化曲线。