题目内容
10.如图与金属腐蚀有关的说法,正确的是( )| A. | 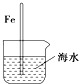 插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 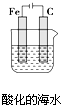 插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 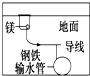 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的阴极 |
分析 A.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快;
B.该装置为电解池,铁棒连接电源的负极,不易被腐蚀;
C.温度越高,铁越容易被氧化;
D.牺牲阳极的阴极保护法中,作负极的金属易被腐蚀.
解答 解:A.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,插入海水中的铁棒,越靠近底端氧气的浓度越小,则腐蚀越轻,故A错误;
B.该装置为电解池,铁棒连接了电源的负极,为电解池的阴极,所以铁棒被保护,不易腐蚀,故B错误;
C.温度越高,铁越容易被氧化,所以高温下铁越容易生锈,故C正确;
D.用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D错误;
故选C.
点评 本题考查金属的腐蚀与防护,题目难度中等,明确原电池原理为解答关键,注意掌握金属腐蚀的类型及防护方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
20.某元素M2+核外电子数为24,该元素是下列原子中的( )
| A. | ${\;}_{24}^{52}$Cr | B. | ${\;}_{12}^{24}$Mg | C. | ${\;}_{26}^{56}$Fe | D. | ${\;}_{22}^{48}$Ti |
1.体积为V mL,密度为d g/cm3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为cmol/L,质量分数为ω%,下列表达式中正确的是( )
| A. | c=$\frac{1000ωd}{M}$ | B. | m=Vd | C. | m=Vdω | D. | c=$\frac{1000m}{VM}$m |
18.某学生设计了如图的方法对A盐进行鉴定:由此分析,下列结论中,正确的是( )
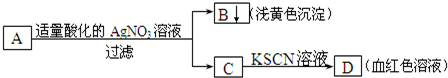

| A. | A中一定有Fe2+ | B. | B为AgI沉淀 | ||
| C. | A中可能有Fe3+ | D. | A一定为FeBr2溶液 |
5.利用下列实验装置能完成相应实验的是( )
| A. |  用于证明非金属性强弱:Cl>C>Si | B. | 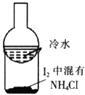 用于分离I2和NH4Cl | ||
| C. |  装置能组成Zn、Cu原电池 | D. |  用于测定某稀盐酸的物质的量浓度 |
15.在四种不同反应条件下,反应A(g)+B(g)=2C(g)+2D(g)的反应速率如下,其中反应最快的是( )
| A. | V(A)=0.15 mol•L-1•S-1 | B. | V(B)=0.3 mol•L-1•S-1 | ||
| C. | V(C)=0.4 mol•L-1•S-1 | D. | V(D)=0.45 mol•L-1•S-1 |
2.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
 .
. ;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.
;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.