题目内容
5.利用下列实验装置能完成相应实验的是( )| A. |  用于证明非金属性强弱:Cl>C>Si | B. | 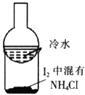 用于分离I2和NH4Cl | ||
| C. |  装置能组成Zn、Cu原电池 | D. |  用于测定某稀盐酸的物质的量浓度 |
分析 A.盐酸易挥发,应先除去盐酸,且不能用盐酸;
B.加热时碘升华,氯化铵分解;
C.根据原电池的构成条件和工作原理来回答;
D.氢氧化钠溶液不能用酸式滴定管盛装.
解答 解:A.盐酸易挥发,应先除去盐酸,且比较非金属的强弱应用最高价氧化物的水化物,用盐酸不能比较Cl和C的非金属性强弱,故A错误;
B.加热时碘升华,氯化铵分解,则图中装置不能分离混合物,故B错误;
C.该装置可以构成Zn、Cu原电池,故C正确;
D.氢氧化钠溶液不能用酸式滴定管盛装,故D错误.
故选C.
点评 本题考查较为综合,涉及非金属性的比较、物质的分离、原电池以及中和滴定等知识,综合考查学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握相关实验方法和注意事项,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 950mL 111.2g | B. | 500mL 117g | ||
| C. | 1 000mL 117g | D. | 任意规格 111.2g |
13.下列有关金属及其化合物说法不正确的是( )
| A. | Al2O3熔点很高,可用作熔融NaOH的坩埚材料 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
20.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是( )
| A. | 每转移l.2 mol电子,有0.2mol硫被氧化 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1molCu2S,有4mol硫被氧化 | |
| D. | SO2只是氧化产物 |
10.如图与金属腐蚀有关的说法,正确的是( )
| A. | 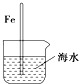 插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 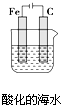 插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 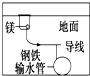 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的阴极 |
17.金属在人类社会的发展进程中起着重要的作用.下列有关金属及其化合物的说法正确的是( )
| A. | Fe、Mg.Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe2O3,H2O被还原生成H2 | |
| C. | 鉴别Na2CO3和NaHCO3溶液可向两种溶液中加入Ba(OH)2溶液,产生沉淀的就是Na2CO3 | |
| D. | Al与NaOH溶液的反应中,NaOH既不是氧化剂又不是还原剂 |
14.人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐,则使血红蛋白中Fe2+转化为Fe3+丧失其生理功能,临床证明服用维生素C可以解毒.下列叙述正确的是( )
| A. | 中毒反应中亚硝酸盐是氧化剂 | |
| B. | 维生素C能将Fe3+氧化为Fe2+,使其解毒 | |
| C. | 中毒反应中Fe3+是还原产物 | |
| D. | 维生素C能将亚硝酸盐氧化成硝酸盐,使其解毒 |
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 常温常压下,14.0g乙烯与丙烯的混合物红含有氢原子的数目为2NA |