题目内容
19.(1)发射卫星的火箭推进器中大多使用的燃料是偏二甲肼,其化学式为 C2H8N2.试计算:①偏二甲肼的摩尔质量是60g/mol;480g偏二甲肼的物质的量为8mol.
②偏二甲肼中碳原子与氮原子的个数之比是1:1,物质的量之比是1:1;若偏二甲肼中含有的氢原子数目为14NA,偏二甲肼的质量为105g.
(2)在同温同压下:
①相同体积的CH4、O2、O3三种气体的质量之比为1:2:3,物质的量之比是1:1:1;
②相同质量的三种气体的体积之比为3:2:1,物质的量之比是3:2:1;
③在标准状况下,氢气与氧气的密度之比为1:16;
④在标准状况下,5.7gO2和O3所占的体积为3.36L,该混合气体的平均相对分子质量为38;O2占混合气体的质量分数为31.6%.
分析 (1)①摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据n=$\frac{m}{M}$计算480g偏二甲肼的物质的量;
②根据化学式确定偏二甲肼中碳原子与氮原子的个数之比、物质的量之比;1molC2H8N2含8molH原子,故当偏二甲肼中含有的氢原子数目为14NA时,偏二甲肼的物质的量为1.75mol,据此求出其质量m=nM;
(2)①同温同压下,相同体积的任何气体的物质的量相同,故质量之比等于摩尔质量之比;
②在同温同压下,相同质量的气体的体积之比与摩尔质量成反比,体积之比等于物质的量之比;
③在相同状态下,气体的密度之比等于摩尔质量之比;
④根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,根据M=$\frac{m}{n}$计算混合气体的平均摩尔质量,令O2和O3的物质的量分别为xmol、ymol,根据二者总物质的量、总质量列方程计算.
解答 解:(1)①C2H8N2的相对分子质量为60,故其摩尔质量为60g/mol,480g偏二甲肼的物质的量为$\frac{480g}{60g/mol}$=8mol,故答案为:60g/mol;8mol;
②根据偏二甲肼化学式C2H8N2,可知碳原子与氮原子的个数之比2:2=1:1、C、N原子物质的量之比为1:1;1molC2H8N2含8molH原子,故当偏二甲肼中含有的氢原子数目为14NA时,偏二甲肼的物质的量为1.75mol,质量m=nM=1.75mol×60g/mol=105g,故答案为:1:1,1:1,105;
(2)①同温同压下,相同体积的任何气体的物质的量相同,即在同温同压下相同体积的CH4、O2、O3三种气体的物质的量之比为1:1:1,质量之比等于摩尔质量之比,故质量之比为16:32:48=1:2:3,故答案为:1:2;3,1:1:1;
②在同温同压下,相同质量的气体的体积之比与摩尔质量成反比,故相同质量CH4、O2、O3三种气体的体积之比等于3:2:1,而体积之比等于物质的量之比,故物质的量之比也为3:2:1,故答案为:3:2:1;3:2:1;
③在相同状态下,气体的密度之比等于摩尔质量之比,故氢气和氧气的密度之比等于2:32=1;16,故答案为:1:16;
④混合气体的总物质的量n=$\frac{V}{{V}_{m}}$=$\frac{3.36L}{22.4L/mol}$=0.15mol,故平均相对分子质量即平均摩尔质量M=$\frac{m}{n}$=$\frac{5.7g}{0.15mol}$=38g/mol,令O2和O3的物质的量分别为xmol、ymol,根据物质的量共有0.15mol,则得:x+y=0.15mol ①;
根据质量共为5.7g,可有:32x+48y=5.7g ②;
解①②两式可得:x=0.05625mol
则氧气的质量m=nM=0.05625mol×32g/mol=1.8g,故氧气在混合气体中的质量分数=$\frac{1.8g}{5.7g}×100%$=31.6%
故答案为:38;31.6%.
点评 本题考查了阿伏伽德罗定律和常用化学计量的有关计算,侧重对基础知识的考查,注意对公式的理解与灵活运用.

| A. | 1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度为1 mol•L-1 | |
| B. | 标准状况下,22.4 L HCl溶于1 L水中形成的溶液体积为1 L | |
| C. | 标准状况下,将33.6 L HCl溶于水形成1 L溶液,其物质的量浓度是1.5 mol•L-1 | |
| D. | 1 mol CaCl2溶于水形成1 L溶液,所得溶液中c(Cl-)等于1 mol•L-1 |
| A. | 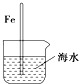 插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 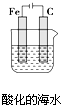 插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 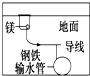 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的阴极 |
| A. | 中毒反应中亚硝酸盐是氧化剂 | |
| B. | 维生素C能将Fe3+氧化为Fe2+,使其解毒 | |
| C. | 中毒反应中Fe3+是还原产物 | |
| D. | 维生素C能将亚硝酸盐氧化成硝酸盐,使其解毒 |
| A. | 在1mol CaC2、KHSO4、Na2O2三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 1molCu和足量热浓硫酸反应可生成nA个SO3分子 | |
| C. | 3mol单质Fe完全转变为Fe3O4,失去8nA个电子 | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
| A. | 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| C. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| D. | 加适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率 |

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$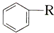 +HCl
+HCl
 .
. .
.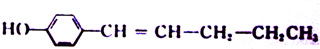 .
. 完成下列各小题.
完成下列各小题.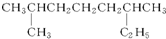 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
;