题目内容
15.聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代.以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程示意图;下列有关说法中错误的是( )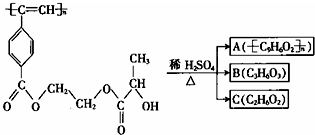
| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
分析 M中含-COOC-,水解得到A为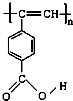 ,C为HOCH2CH2OH,B为
,C为HOCH2CH2OH,B为 ,结合-COOH、-OH、C=C的性质来解答.
,结合-COOH、-OH、C=C的性质来解答.
解答 解:M中含-COOC-,水解得到A为 ,C为HOCH2CH2OH,B为
,C为HOCH2CH2OH,B为 ,
,
A.M、A中均含碳碳双键,则均能使酸性高锰酸钾溶液和溴水褪色,故A正确;
B.B中含-OH、-COOH,-OH可发生消去反应,-OH、-COOH可发生酯化反应,故B正确;
C.1molM中含2nmol-COOC-,则1molM与热的烧碱溶液反应,可消耗2n mol的NaOH,故C正确;
D.由2-COOH~2-OH~H2↑可知,A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为n:2:2,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酯、醇、羧酸性质的考查,注意A、M均为高分子化合物,题目难度不大.

练习册系列答案
相关题目
3.下列离子方程式书写正确的是( )
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
10.某原电池装置如图所示.下列有关叙述中,正确的是( )
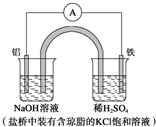

| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
4.下列物质中和乙酸一定不反应的是( )
| A. | Ba(OH)2 | B. | CaCO3 | C. | Na2SO4 | D. | CH3CH2OH |
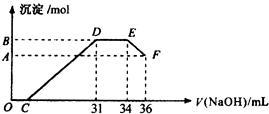 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.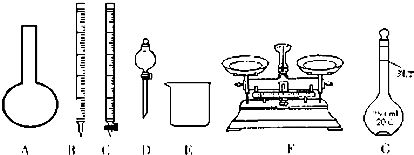
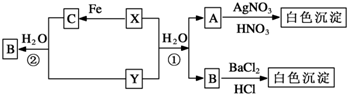
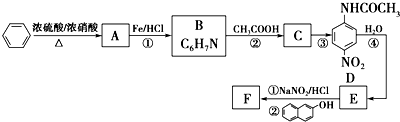
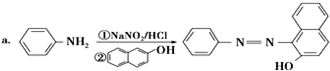
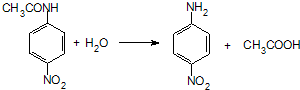 .
.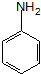 ;设计反应②和④的目的是保护氨基不被氧化.
;设计反应②和④的目的是保护氨基不被氧化.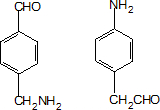 .
.