题目内容
10.某原电池装置如图所示.下列有关叙述中,正确的是( )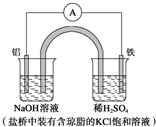
| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
分析 铝为负极,被氧化,电极反应为Al-3e-+4OH-═AlO2-+2H2O,铁为正极,发生还原反应,电极反应为2H++2e-=H2↑,结合电极反应解答.
解答 解:A.铁为正极,发生还原反应,故A错误;
B.铝为负极,被氧化,电极反应为Al-3e-+4OH-═AlO2-+2H2O,故B错误;
C.右烧杯发生2H++2e-=H2↑,氢离子浓度减小,则pH增大,故C错误;
D.铝为负极,氯离子向左边负极移动,使该烧杯中溶液保持电中性,故D正确.
故选D.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,为高考高频考点,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
7.如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升,下列说法正确的是( )
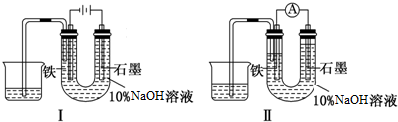

| A. | 装置I中石墨电极处得到气体的体积比铁电极处得到气体的体积大 | |
| B. | 用装置Ⅱ进行实验时铁电极的电极反应为 Fe-2e-+2OH-═Fe(OH)2↓ | |
| C. | 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-═H2↑ | |
| D. | 装置I通电10分钟后,溶液的pH降低 |
5.将C棒、Fe棒平行插人饱和NaCl溶液中(如图所示).下列叙述符合事实的是( )
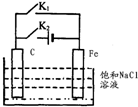

| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
15.聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代.以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程示意图;下列有关说法中错误的是( )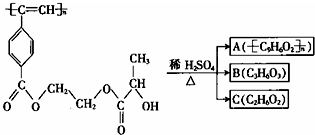

| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
19.下列各组混合物中,不能混溶的是( )
| A. | 植物油和乙醇 | B. | 苯和水 | C. | 酒精和水 | D. | 汽油和煤油 |

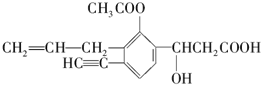 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题: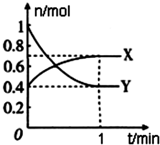 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.