题目内容
3.下列离子方程式书写正确的是( )| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
分析 A.硫化钠过量,亚铁离子与硫离子反应生成硫化亚铁沉淀;
B.铁与稀硫酸反应生成氯化亚铁,不是生成铁离子;
C.铜作电解,阳极铜放电,氢氧根离子与铜离子反应生成氢氧化铜沉淀;
D.铁离子与铜反应生成亚铁离子和铜离子.
解答 解:A.向Fe2(SO4)3溶液中加入过量的Na2S,反应生成硫化亚铁沉淀,正确的离子方程式为:2Fe3++3S2-=2FeS↓+S↓,故A错误;
B.将铁粉加入稀硫酸中,反应生成亚铁离子和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故B错误;
C.用铜电极电解饱和食盐水,阳极铜放电,正确的离子方程式为:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,故C错误;
D.将铜屑加入Fe3+溶液中,二者发生氧化还原反应,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;C为易错点,注意电解材料为铜,阳极铜放电.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14.某无色透明的强酸性溶液中,能大量共存的一组离子是( )
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
11.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是( )
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | CH3CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
15.聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代.以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程示意图;下列有关说法中错误的是( )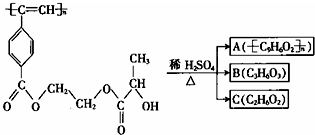

| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
13.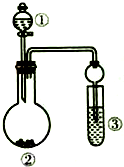 利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
 利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓氨水 | CaO | 滴有酚酞的水 | 氨气显碱性 |
| B | 浓盐酸 | MnO2 | 淀粉碘化钾溶液 | 氧化性:Cl2>I2 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均能反应生成白色沉淀 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:硫>碳>硅 |
| A. | A | B. | B | C. | C | D. | D |
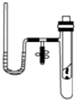 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.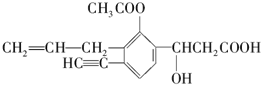 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题: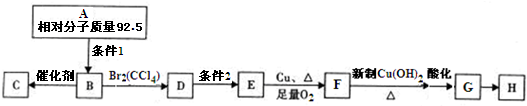
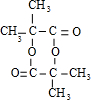 .
. ;
;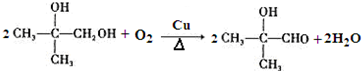 .
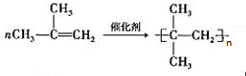
.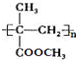 )的合成路线为
)的合成路线为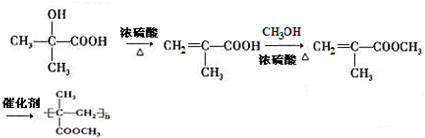 .
.