题目内容
18.铜、银均属于重金属,从铜银合金废料中回收银并制备含铜化合物产品的工艺如图: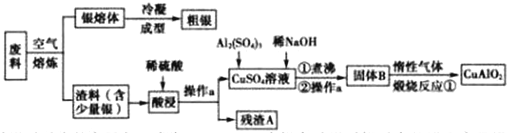
(1)酸浸时反应的离子方程式为CuO+2H+=Cu2++H2O.为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是将渣料粉碎.
(2)操作a是过滤.
(3)已知固体B中含有CuO和Al2O3,反应①的化学方程式为4CuO+2Al2O3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+O2↑.
(4)若残渣A中含有b mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的离子方程式3Ag+4H++NO3-=3Ag++NO↑+2H2O,为消除污染,可将反应中产生的气体与VL(标准状况)空气混合通入水中,则V至少为28b(设空气中氧的体积分数为0.2).
分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水;增大反应物接触面积,能够加快反应速率;
(2)分离固体与液体用到操作为过滤;
(3)依据图中转化关系可知:CuO和Al2O3,灼烧反应生成4CuAlO2和O2;
(4)Ag与稀硝酸反应生成硝酸银、NO与水;为消除污染,应让反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,据此计算氧气物质的量,再计算需要氧气的体积,结合空气中氧气体积分数计算需要空气体积.
解答 解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)CuO与硫酸反应生成硫酸铜与水,反应离子方程式:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤,故答案为:过滤;
(3)CuO和Al2O3,灼烧反应生成4CuAlO2和O2,方程式为:4CuO+2Al2O3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+O2↑,故答案为:4CuO+2Al2O3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+O2↑;
(4)Ag与稀硝酸反应生成硝酸银、NO与水,反应的离子方程式为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,故消耗氧气物质的量为$\frac{bmol×1}{4}$=0.25bmol,标况下需要氧气的体积为0.25bmol×22.4L/mol=5.6bL,需要空气的体积为5.6b L÷20%=28b L,
故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;28b.
点评 本题以从废料中回收银并制备铜化工产品载体,考查化学工艺流程、物质分离提纯、电解原理、氧化还原反应配平与计算,明确流程图中物质之间的转化关系,把握氧化还原反应中电子转移守恒规律是解题关键,题目难度中等.

| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1:
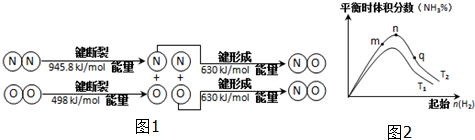
该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
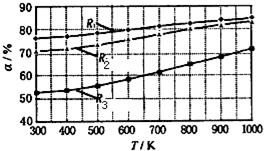 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
| A. | H2 | B. | 2H | C. | 2H+ | D. | 2H2 |
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |