题目内容
15.在中考体育考试中,很多学生在测试结束后感觉小腿酸痛,这是因为在剧烈的高强度运动中,人体内的葡萄糖(C6H12O6)会进行无氧反应,产生乳酸(C3H6O3),下列说法正确的是( )| A. | 乳酸是一种氧化物 | |
| B. | 1个乳酸分子是由3个碳原子和3个水分子构成 | |
| C. | 葡萄糖与乳酸中所含的原子种类相同 | |
| D. | 葡萄糖不能为人体提供能量 |
分析 A、氧化物是两种元素组成其中一种为氧元素的化合物;
B、分子是由原子构成的;
C、葡萄糖(C6H12O6)和乳酸(C3H6O3)分子中都是由氢原子、碳原子、氧原子构成;
D、葡萄糖转化过程中为人提供能量;
解答 解:A、乳酸分子式可知是由三种元素组成的有机物,不是氧化物,故A错误;
B、分子是由原子构成,不能分子构成分子,1个乳酸分子中由3个碳原子,6个氢原子,3个氧原子构成,故B错误;
C、葡萄糖(C6H12O6)和乳酸(C3H6O3)分子中都是由氢原子、碳原子、氧原子构成,所含的原子种类相同,故C正确;
D、是生命活动中不可缺少的物质,它在人体内能直接参与新陈代谢过程,为人提供必需的能量,故D错误;
故选C.
点评 本题考查了物质组成和构成的理解应用,掌握基础是关键,注意微粒构成物质、元素组成物质的理解应用,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.化学与环境?材料?信息?能源关系密切,下列说法不正确的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点?沸点 | |
| C. | 先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅 |
6.下列装置能用于实验室制备HCl气体的是( )
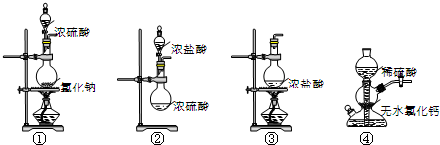

| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
3. 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
10.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H | C. | 2H+ | D. | 2H2 |
5.某研究性学习小组向一定童的NaHSO3溶液(加入少量淀粉)中加人稍过量的KIO3溶液,一段时间后.溶液突然变蓝色.为进一步研究有关因素对该反应速率的影响,探究如下.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2 (填“>”、“=”或“<“);
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.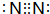 ,E属于元素周期表中ds区
,E属于元素周期表中ds区