题目内容
【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
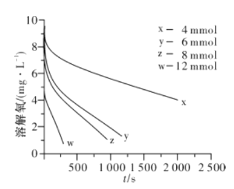
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
【答案】2Na2SO3(aq) +O2(g)=2Na2SO4(aq) H=(x+y)kJ/mol 1×10-5 2 0 < 24300MPa-1 ![]()
【解析】
(1) 2Na2SO3(aq) +O2 (aq)=2Na2SO4(aq) H=x kJ/mol ①;
O2(g) ![]() O2(aq) H=y kJ/mol②;
O2(aq) H=y kJ/mol②;
将方程式①+②得2Na2SO3 (aq) +O2 (g)=2Na2SO4(aq) H=(x+y)kJ/mol;
(2) 0~20s内溶解氧浓度变化量=(9.60-6.40)mg/L=3.20mg/L=3.20×10-3g/L,则△c(O2)=![]() =10-4mol/L,根据方程式得△c(Na2SO3)=2△c(O2)=2×10-4mol/L,0~20s内Na2SO3的平均反应速率v=
=10-4mol/L,根据方程式得△c(Na2SO3)=2△c(O2)=2×10-4mol/L,0~20s内Na2SO3的平均反应速率v=![]() =1×10-5molL-1s-1;
=1×10-5molL-1s-1;
(3)①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,v1:v2=c1a(SO32-):c2a(SO32-),![]() ,解得a=2;
,解得a=2;
②当溶解氧浓度小于4.0mgL-1时,图中曲线皆为直线,说明该方程为一次函数,k为常数,v与c(SO32-)有关,溶解氧浓度对v无影响,所以b=0;
(4) ln![]() 随着Ea的增大而增大,富氧区的ln
随着Ea的增大而增大,富氧区的ln![]() 较小,故Ea(富氧区)<Ea(贫氧区);
较小,故Ea(富氧区)<Ea(贫氧区);
(5)
设平衡时的总压强P,![]() ,P=0.07 MPa,Kp=
,P=0.07 MPa,Kp=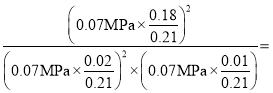 24300MPa-1;
24300MPa-1;
(6)SO2和O2来制备硫酸,硫元素化合价升高,负极为SO2失电子生成硫酸根离子,反应的离子方程式是![]() 。
。