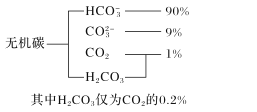
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B.常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.05NA
D.将0.1mol O2与0.2mol NO在密闭容器中充分反应,反应后容器内分子数为0.2NA
【答案】B
【解析】
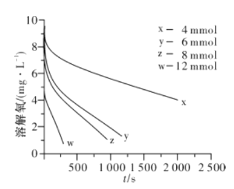
A.25℃时,该溶液pH=13,c(H+)=10-13mol/L,c(OH-)= 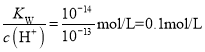 ,1L该溶液中含有的OH-数目为(0.1mol/L×1L)NA=0.1NA,故A错误;
,1L该溶液中含有的OH-数目为(0.1mol/L×1L)NA=0.1NA,故A错误;
B.常温下,pH=10的溶液中c(H+)=10-10mol/L,溶液中H+均为水电离,因此1L该氨水溶液中,发生电离的水分子数为(1L×10-10mol/L)NA,故B正确;
C.阴极上铜离子放电:Cu2++2e=Cu,故当阴极增重32g即生成0.05mol铜时,转移0.1mol电子即0.1NA个,故C错误;
D.NO和氧气反应后生成的NO2中存在平衡:2NO2N2O4,导致分子个数减少,故反应后容器中的分子个数小于0.2NA个,故D错误;
故答案为:B。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有_________________________________________。
A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是___________________。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?____________(填“能”或“不能”),理由是_________________________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取_______g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有_____________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________(填“偏大”、“偏小”或“不变”)。
【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
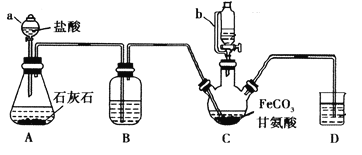
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。