题目内容
12.下列有关说法不正确的是( )
| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |
分析 A、将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,醋酸物质的量和氢氧化钠物质的量相同,恰好完全反应溶液显碱性;
B、稀释等pH的两种酸,稀释相同倍数时,pH变化越快的酸酸性越强,等浓度的钠盐溶液,弱酸的钠盐溶液pH大;
C、根据氢离子浓度计算氢氧根离子浓度,酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度;
D、化学反应是否能自发进行,取决于焓变和熵变,根据△G=△H-T•△S,如△G<0,则反应能自发进行.
解答 解:A、将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合,氢氧化钠溶液浓度为10-3mol/L,醋酸和氢氧化钠恰好完全反应,CH3COOH+NaOH=CH3COONa+H2O,生成的醋酸钠是强碱弱酸盐,草酸跟离子水解,溶液显碱性,故A正确;
B.根据图象知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,则相同浓度的钠盐溶液中,NaA溶液的pH小于同浓度的NaB溶液的pH,故B错误;
C、相同温度下,pH=2的醋酸溶液中水的离子积常数不变,所以溶液中水电离出的H+的数目和氢氧根离子浓度相同,所以水电离出的c(H+)为10-12mol/L,故C正确;
D、根据△G=△H-T•△S,吸热反应△H>0,则只有△S>0,才能使△G<0,吸热反应能自发进行,则该反应一定是熵增的反应,故D正确;
故选B.
点评 本题考查酸碱混合溶液定性判断,题目难度中等,明确弱电解质的特点是解本题关键,注意盐类水解的分析判断,明确计算的是溶液中氢离子浓度还是水电离出的氢离子浓度,掌握基础是关键.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
3.下列说法正确的是( )
| A. | 正丁烷和异丁烷互为同分异构体 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 淀粉和蛋白质的水解产物都是氨基酸 | |
| D. | 葡萄糖和蔗糖都能发生水解反应 |
20.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
17.下列说法错误的是( )
| A. | 可利用废油脂制肥皂 | |
| B. | 袋装食品常用生石灰包作为食品的抗氧化剂 | |
| C. | 配制CuSO4溶液时加入少量的稀硫酸 | |
| D. | 用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
1.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4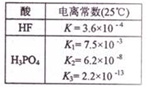 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
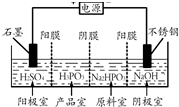 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
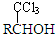 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾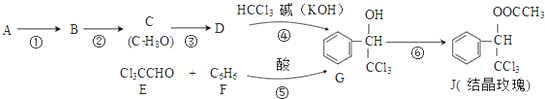
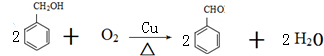 .
.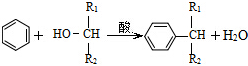 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.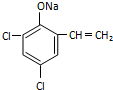 或
或 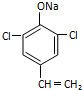 (只写一种).
(只写一种).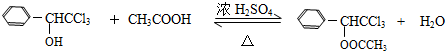 .
.