题目内容
4.已知:RCHO$\stackrel{CHCl_{3}}{→}$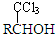 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾可由下列反应路线合成结晶玫瑰(只列出部分反应条件)
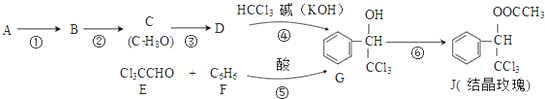
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是甲苯.
(2)C中的官能团是羟基.
(3)反应③的化学方程式为
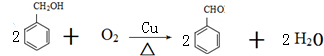 .
.(4)经反应路线④得到的副产物加水萃取、分液,能除去的副产物是苯甲酸钾.
(5)已知:
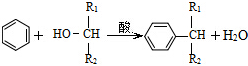 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
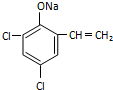
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.(6)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,能发生消去反应,所得有机物的结构简式为
 或
或 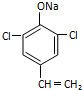 (只写一种).
(只写一种).(7)⑥的化学方程式是
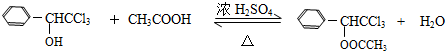 .
.(8)C有多种同分异构体,其中属于芳香族化合物的有4种(不包括C).
分析 A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则Mr(A)=46×2=92,令其分子式为CnH2n-6,则14n-6=92,解得n=7,故A为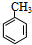 ,反应④信息中的加成反应,结合G的结构,逆推可知D为
,反应④信息中的加成反应,结合G的结构,逆推可知D为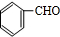 ,结合C分子可知C为
,结合C分子可知C为 ,则反应①可以是甲苯与氯气在光照条件下发生取代反应生成
,则反应①可以是甲苯与氯气在光照条件下发生取代反应生成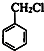 ,反应②为
,反应②为 在氢氧化钠水溶液、加热条件下发生水解反应得到苯甲醇,反应⑤是E与F(苯)发生加成反应生成G,G与乙酸发生酯化反应得到J.
在氢氧化钠水溶液、加热条件下发生水解反应得到苯甲醇,反应⑤是E与F(苯)发生加成反应生成G,G与乙酸发生酯化反应得到J.
(4)反应④发生副反应: $\stackrel{KOH}{→}$苯甲醇+苯甲酸钾,苯甲酸钾溶于水;
$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾,苯甲酸钾溶于水;
(5)由已知中物质结构可知,该反应为取代反应,反应中羟基被苯环取代,反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,而G中苯环上含有3种H原子,则该副产物为G中羟基被苯环取代,该副产物为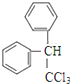 ;
;
(6)G的同分异构体L遇FeCl3溶液显色,含有酚羟基,与足量饱和溴水反应未见白色沉淀产生,酚羟基邻位、对位位置没有H原子,L与NaOH的乙醇溶液共热,能能发生消去反应,该基团是-C2H4Cl,则L为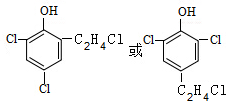 ,L与NaOH的乙醇溶液共热发生卤代烃消去反应、酚羟基与氢氧化钠中和反应;
,L与NaOH的乙醇溶液共热发生卤代烃消去反应、酚羟基与氢氧化钠中和反应;
(7)反应⑥是G与乙酸发生的酯化反应;
(8)C( )有多种同分异构体,其中属于芳香族化合物,含有苯环,不包括C,可以含有1个侧链为-OCH3,含有含有2个侧链为-OH、-CH3,有邻、间、对3种.
)有多种同分异构体,其中属于芳香族化合物,含有苯环,不包括C,可以含有1个侧链为-OCH3,含有含有2个侧链为-OH、-CH3,有邻、间、对3种.
解答 解:A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则Mr(A)=46×2=92,令其分子式为CnH2n-6,则14n-6=92,解得n=7,故A为 ,反应④信息中的加成反应,结合G的结构,逆推可知D为
,反应④信息中的加成反应,结合G的结构,逆推可知D为 ,结合C分子可知C为
,结合C分子可知C为 ,则反应①可以是甲苯与氯气在光照条件下发生取代反应生成
,则反应①可以是甲苯与氯气在光照条件下发生取代反应生成 ,反应②为
,反应②为 在氢氧化钠水溶液、加热条件下发生水解反应得到苯甲醇,反应⑤是E与F(苯)发生加成反应生成G,G与乙酸发生酯化反应得到J.
在氢氧化钠水溶液、加热条件下发生水解反应得到苯甲醇,反应⑤是E与F(苯)发生加成反应生成G,G与乙酸发生酯化反应得到J.
(1)由上述分析可知,A为 ,名称为:甲苯,故答案为:甲苯;
,名称为:甲苯,故答案为:甲苯;
(2)C为 ,含有的官能团是:羟基,故答案为:羟基;
,含有的官能团是:羟基,故答案为:羟基;
(3)反应③是苯甲醇发生催化氧化生成苯甲醛,反应化学方程式为: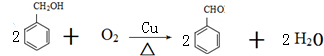 ,
,
故答案为: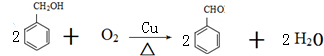 ;
;
(4)反应④发生副反应: $\stackrel{KOH}{→}$苯甲醇+苯甲酸钾,副产物加水萃取、分液,苯甲酸钾溶于水,能除去的副产物是苯甲酸钾,故答案为:苯甲酸钾;
$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾,副产物加水萃取、分液,苯甲酸钾溶于水,能除去的副产物是苯甲酸钾,故答案为:苯甲酸钾;
(5)由已知中物质结构可知,该反应为取代反应,反应中羟基被苯环取代,反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,而G中苯环上含有3种H原子,则该副产物为G中羟基被苯环取代,该副产物为 ,各组吸收峰的面积之比为1:2:4:4,
,各组吸收峰的面积之比为1:2:4:4,
故答案为:1:2:4:4;
(6)G的同分异构体L遇FeCl3溶液显色,含有酚羟基,与足量饱和溴水反应未见白色沉淀产生,酚羟基邻位、对位位置没有H原子,L与NaOH的乙醇溶液共热,能能发生消去反应,该基团是-C2H4Cl,则L为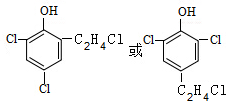 ,L与NaOH的乙醇溶液共热发生卤代烃消去反应、酚羟基与氢氧化钠中和反应,反应产物为:
,L与NaOH的乙醇溶液共热发生卤代烃消去反应、酚羟基与氢氧化钠中和反应,反应产物为: 或
或  ,
,
故答案为: 或
或  ;
;
(7)反应⑥是G与乙酸发生的酯化反应,反应方程式为: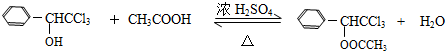 ,
,
故答案为: ;
;
(8)C( )有多种同分异构体,其中属于芳香族化合物,含有苯环,不包括C,可以含有1个侧链为-OCH3,含有含有2个侧链为-OH、-CH3,有邻、间、对3种,属于芳香族化合物的有4种(不包括C),
)有多种同分异构体,其中属于芳香族化合物,含有苯环,不包括C,可以含有1个侧链为-OCH3,含有含有2个侧链为-OH、-CH3,有邻、间、对3种,属于芳香族化合物的有4种(不包括C),
故答案为:4.
点评 本题考查有机物推断、官能团的结构与性质、同分异构体书写、对信息的迁移应用等,注意根据有机物的结构与给予的信息进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案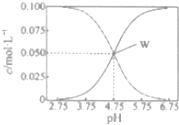 25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 25℃时,醋酸的电离常数Ka=1×10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |

| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |

| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |
| A. | 含碳元素的化合物都是有机物 | B. | 乙烯的结构简式是C2H4 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 蔗糖的分子式是C12H22O11 |
| 元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
| A. | 元素④的原子序数小于元素⑦的原子序数 | |
| B. | ②、③处于同一周期 | |
| C. | 上述八种元素中.最高价氧化物对应水化合物酸性最强的元素是⑤ | |
| D. | ⑧号元素原子结构示意图为: |
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H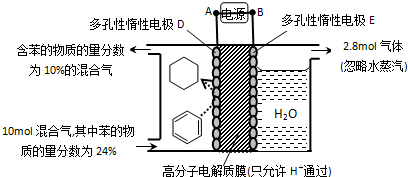
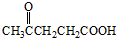 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
 +SOCl2→
+SOCl2→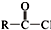 +SO2+HCl
+SO2+HCl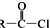 +R′OH→
+R′OH→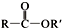 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基) .
. .
.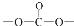 结构;
结构; .
.