题目内容
2.下列离子方程式或化学方程式与所述事实相符且正确的是( )| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4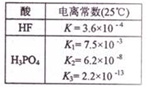 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
分析 A.氟化氢的电离常数大于磷酸的第二次的电离平衡常数,则反应生成NaH2PO4;
B.阳极铜放电生成铜离子,阴极水电离的氢离子得到电子生成氢气,反应生成、氢氧化铜;
C.0.1mol?L-1的NaHA溶液的pH=1,说明NaHA在溶液中完全电离出氢离子;
D.氢氧化钠与碳酸钠的物质的量相等,若盐酸足量,则其计量数应该相等.
解答 解:A.HF的电离常数大于H2PO4-的电离平衡常数,则反应生成NaH2PO4,正确的化学方程式为:NaF+H3PO4═HF+NaH2PO4,故A错误;
B.以金属铜为电极电解饱和NaCl溶液,阳极放电的为金属铜,正确的离子方程式为:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,故B错误;
C.0.1mol?L-1的NaHA溶液的pH=1,说明NaHA在溶液中完全电离出H+,加入氢氧化钠溶液后发生中和反应:H++OH-═H2O,故C正确;
D.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,若稀盐酸过量时,反应的离子方程式为:2OH-+2CO32-+6H+═CO2↑+4H2O,故D错误;
故选C.
点评 本题考查了离子方程式、化学方程式的书写,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式、化学方程式的书写原则,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
12.下列有关说法不正确的是( )


| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |
13.下列说法正确的是( )
| A. | 含碳元素的化合物都是有机物 | B. | 乙烯的结构简式是C2H4 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 蔗糖的分子式是C12H22O11 |
10.利用下列装置进行相应实验,有关说法不正确的是( )

| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
17.根据中学所学相关知识,下列判断正确的一项是( )
| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KEr溶液中的溴,则氟气也可置换出KBr中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+dmon•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
7.有两种气态烷烃的混合物,在标准状况下其密度为1.16g•L-1,则关于此混合物组成的说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是甲烷和乙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
14.下表为几种短周期元素的性质
对上述元素有关说法正确的是( )
| 元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
| A. | 元素④的原子序数小于元素⑦的原子序数 | |
| B. | ②、③处于同一周期 | |
| C. | 上述八种元素中.最高价氧化物对应水化合物酸性最强的元素是⑤ | |
| D. | ⑧号元素原子结构示意图为: |
6.下列有关NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O═SO42-+2Fe2++2H+ | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |

 ;
;