题目内容
1.下列实验“操作和现象”与“结论”对应关系正确的是( )| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CH4和Cl2发生取代反应;
B.加热促进碳酸氢钠的水解;
C.银镜反应应在碱性条件下进行;
D.硝酸根离子在酸性条件下具有氧化性,可氧化亚铁离子.
解答 解:A.CH4为饱和烃,与Cl2发生取代反应,故A错误;
B.碳酸氢钠在溶液中加热不反应,加热促进碳酸氢钠的水解,溶液碱性增强,故B错误;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖的银镜反应应在碱性条件下进行,故C错误;
D.硝酸根离子在酸性条件下具有氧化性,可氧化亚铁离子,生成NO被氧化生成红棕色的NO2,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的检验、性质比较等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
11.下列有关(NH4)2SO3溶液的叙述正确的是( )
| A. | 该溶液中,Na+、Fe3+、NO3-、Cl-可能大量共存 | |
| B. | 和溴水反应的离子方程式:Br2+SO32-+H2O=2H++2Br-+SO42- | |
| C. | 和Ba(OH)2溶液加热反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 1L0.1mol•L-1该溶液和足量的硝酸充分反应,生成2.24L(标准状况)SO2气体 |
12.下列有关说法不正确的是( )


| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |
6.下列说法正确的是( )
| A. | 鸡蛋清溶液中加入醋酸铅溶液,会发生盐析 | |
| B. | 青苹果中富含苹果酸,因此苹果是酸性食物 | |
| C. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| D. | 氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 |
13.下列说法正确的是( )
| A. | 含碳元素的化合物都是有机物 | B. | 乙烯的结构简式是C2H4 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 蔗糖的分子式是C12H22O11 |
10.利用下列装置进行相应实验,有关说法不正确的是( )

| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H
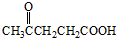 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
 +SOCl2→
+SOCl2→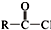 +SO2+HCl
+SO2+HCl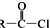 +R′OH→
+R′OH→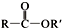 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基) .
. .
. 结构;
结构; .
.
 ;
;