题目内容
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
分析 Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素,以此解答该题.
解答 解:Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素,
A.Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故A错误;
B.Y为S元素,处于第三周期第ⅥA族,故B正确;
C.X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;
D.Z为As元素,是33号元素,其元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确.
故选A.
点评 本题考查结构与位置关系、核外电子排布规律、元素周期表等,难度不大,推断Y元素是解题的关键,注意基础知识的掌握.

练习册系列答案
相关题目
7.某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:
仪器:①试管;②胶头滴管 (请填写两种主要玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下列空格内填写相关内容)
(4)实验结论:同一主族元素,自上而下,元素的非金属性依次减弱
(5)问题和讨论:
①请用物质结构理论简单说明得出上述结论的原因:同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱.试至少列举1个事实说明F的非金属性比Cl强:HF的稳定性强于HCl.
(1)实验目的:探究同一主族元素性质的递变规律
(2)实验用品:
仪器:①试管;②胶头滴管 (请填写两种主要玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容(在下列空格内填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中, 振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫红色 |
(5)问题和讨论:
①请用物质结构理论简单说明得出上述结论的原因:同一主族元素,自上而下,元素原子的电子层数增多,原子半径增大,原子核对最外层电子的吸引力逐渐减弱
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱.试至少列举1个事实说明F的非金属性比Cl强:HF的稳定性强于HCl.
4.关于化学反应速率、反应限度的下列说法中正确的是( )
| A. | 其他条件不变时,升高温度,化学反应速率加快 | |
| B. | 其他条件不变时,增大浓度,化学反应速率加快 | |
| C. | 化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 | |
| D. | 化学反应的限度是不可以改变的 |
11.高纯度镍是许多有机反应的催化剂.某化学课题组拟以电镀废液(含有NiSO4、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如图1所示(阴离子省略):

(1)加入新制氯水所发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.

| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
(2)加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去
(3)在实验室中灼烧所使用的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥.
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍.
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点.
方案1:操作简便、节省原料、实验安全.
方案2:产品纯度较高.
(5)方案2所用的氢气可以选用如图2装置中的BD来制取(填写字母,下同),收集氢气可选用装置FH.
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的d.装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下.
a.CO2 b.Cl2 c.NO d.SO2.
1.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(用元素符号表示,下同)
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:

(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
8.下列叙述不正确的是( )
| A. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有6种 | |
| B. | 与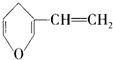 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 | |
| C. | 已知丁基共有四种.不必试写,立即可断定分子式为C5H10O的醛应有4种 | |
| D. | 菲的结构简式为 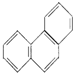 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 |
5.请根据官能团的不同对下列有机物进行分类
①CH3CH2OH ②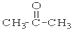 ③CH3CH2Br ④
③CH3CH2Br ④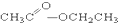 ⑤
⑤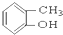 ⑥
⑥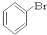 ⑦
⑦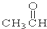 ⑧
⑧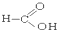 ⑨
⑨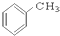 ⑩
⑩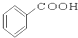
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
①CH3CH2OH ②
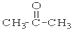 ③CH3CH2Br ④
③CH3CH2Br ④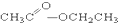 ⑤
⑤ ⑥
⑥ ⑦
⑦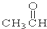 ⑧
⑧ ⑨
⑨ ⑩
⑩
(1)芳香烃:⑨;(2)醇:①;
(3)醛:⑦;(4)酮:②;
(5)酚:⑤;(6)酯:④.
6.随着人们生活质量的不断提高,废电器必须进行集中处理的问题被提到议事日程,其首要原因是( )
| A. | 利用电器中的金属材料 | B. | 防止电器造成污染 | ||
| C. | 废电器经过处理后还可以重新使用 | D. | 回收其中非金属材料 |
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.