题目内容
4.关于化学反应速率、反应限度的下列说法中正确的是( )| A. | 其他条件不变时,升高温度,化学反应速率加快 | |
| B. | 其他条件不变时,增大浓度,化学反应速率加快 | |
| C. | 化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 | |
| D. | 化学反应的限度是不可以改变的 |
分析 一般来说,增大浓度、升高温度可增大反应速率,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此解答该题.
解答 解:A.升高温度,活化分子百分数增大,反应速率增大,故A正确;
B.增大反应物浓度,单位体积的活化分子数目增大,反应速率增大,故B正确;
C.达到平衡状态时,各物质的浓度不变,但不一定相等,故C错误.
D.外界条件改变,平衡状态发生改变,故D错误;
故选AB.
点评 本题考查较为综合,涉及平衡状态和化学反应素的影响因素,为高频考点,侧重于学生的分析能力和基本概念、理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
15.(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→②→①→③.
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
12.以下实验能说明金属A一定比金属B的金属活动性强的是( )
| A. | 金属A在常温下能与浓硝酸反应,而B不能 | |
| B. | 金属A的阳离子的氧化性比金属B的阳离子的氧化性弱 | |
| C. | 工业上制取金属A只能用电解的方法,而金属B一般都用还原剂将其还原 | |
| D. | 将金属A和金属B用导线相连后插入某电解质溶液中构成原电池,金属A作负极 |
19.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
| A. | 丙烷与氯气在光照条件下生成氯丙烷 | |
| B. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| C. | 乙烯与水反应生成乙醇 | |
| D. | 乙烯自身聚合生成聚乙烯 |
9.如图为番茄电池,下列说法正确的是( )


| A. | 一段时间后,铁极质量会变大 | B. | 溶液中的H+向石墨电极移动 | ||
| C. | 电子由石墨电极通过导线流向铁极 | D. | 铁电极是该电池的正极 |
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),
则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
13.有关有机物分子结构或构型的判断,正确的是( )
| A. | 碳氢原子个数比为1:3的烃有两种 | |
| B. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| C. | 丙烷分子中的3个碳原子一定在同一平面上,丁烷分子中的4个碳原子不一定 | |
| D. | 常温下,液态烷中仅有一种一氯代物的只有新戊烷 |
 .
. .
.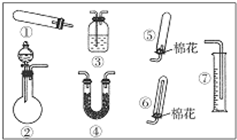 某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:
某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题: