题目内容
6.随着人们生活质量的不断提高,废电器必须进行集中处理的问题被提到议事日程,其首要原因是( )| A. | 利用电器中的金属材料 | B. | 防止电器造成污染 | ||
| C. | 废电器经过处理后还可以重新使用 | D. | 回收其中非金属材料 |
分析 废电器中含有重金属,重金属有毒能污染环境,废电器与生活垃圾一起填埋,渗出的汞及重金属物质会渗透土壤污染地下水,进而进入鱼类、农作物中破坏人类的生存环境,经过食物链的生物放大逐级在较高级的生物中富集,经过食物进入人得身体威胁人类健康,所以必须集中处理.
解答 解:废电器中含有重金属,重金属有毒能污染环境,回收的目的不是利用材料.
故选B.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),
则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
17.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.你的解释是Mn2+的3d轨道电子排布为半满状态较稳定.
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
| 元 素 | M | F | |
| 电能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
1.下列说法正确的是( )
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
11.有机化合物A(C9H10O2)为一种无色液体.从A出发可发生如图的一系列反应.则下列说法正确的是( )


| A. | 根据图示可推知D为苯酚 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有两种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | A的结构中含有碳碳双键 |
18.能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙二醇和水 | ||
| C. | NaCl溶液和高级脂肪酸 | D. | 饱和Na2CO3溶液和乙酸乙酯 |
15.下列叙述错误的是( )
| A. | 工业上,乙苯主要通过苯与乙烯在合适条件下加成反应获得 | |
| B. | 实验室制得的溴苯含有多种有机杂质,除了苯之外,还可能含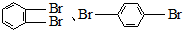 | |
| C. | 萘(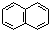 )不是苯的同系物,应属于联苯类芳香烃 )不是苯的同系物,应属于联苯类芳香烃 | |
| D. | D.甲苯与氯气在光照下反应生成的一氯代物主要为 |
16.Q、M两元素相邻,M、C、N原子的最外层电子数之和为13,N原子最外层电子数是M原子内层电子数的3倍或者C原子最外层电子数的3倍,M、D原子最外层电子数之和等于C、N原子最外层电子数之和,短周期主族元素Q、M、C、D、N的原子序数依次递增.下列说法正确的是( )
| A. | 元素Q所形成的氧化物只有一种 | |
| B. | 元素M的最高价氧化物对应的水化物为强酸 | |
| C. | 元素C、D、N的最高价氧化物对应的水化物两两之间可发生反应 | |
| D. | 氢化物的稳定性:Q>M |
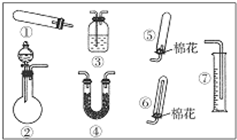 某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:
某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题: