题目内容
1.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
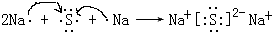
(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
分析 由元素在周期表中的位置可知,①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)稀有气体化学性质稳定;
(2)同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱;
(3)氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物;
(5)二氧化碳是碳原子和氧原子间通过极性共价键形成的共价化合物.
解答 解:由元素在周期表中的位置可知,①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)在这些元素中,化学性质最稳定的是稀有气体Ar,故答案为:Ar;
(2)上述元素中,K的金属性最强,碱性最强的是KOH,故答案为:KOH;
(3)⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为: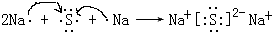 ,
,
故答案为: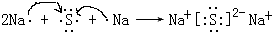 ;
;
(5)③、⑥的氢化物中,水中含氢键,沸点高,沸点较高的是H2O,故答案为:H2O;水分子之间含氢键.
点评 本题考查位置、结构与性质,为高频考点,涉及元素周期表与元素周期律等,题目难度不大,注意电子式的书写以及用电子式表示形成过程的不同.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
12.以下实验能说明金属A一定比金属B的金属活动性强的是( )
| A. | 金属A在常温下能与浓硝酸反应,而B不能 | |
| B. | 金属A的阳离子的氧化性比金属B的阳离子的氧化性弱 | |
| C. | 工业上制取金属A只能用电解的方法,而金属B一般都用还原剂将其还原 | |
| D. | 将金属A和金属B用导线相连后插入某电解质溶液中构成原电池,金属A作负极 |
9.如图为番茄电池,下列说法正确的是( )
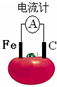

| A. | 一段时间后,铁极质量会变大 | B. | 溶液中的H+向石墨电极移动 | ||
| C. | 电子由石墨电极通过导线流向铁极 | D. | 铁电极是该电池的正极 |
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),
则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
6.设NA为阿佛加德罗常数,下列说法不正确的是( )
| A. | 标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8 NA | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3 NA | |
| C. | 常温常压下,22.4 L甲烷中含C-H键的数目为4NA | |
| D. | 常温常压下,3g甲醛分子中含电子数1.6 NA |
13.有关有机物分子结构或构型的判断,正确的是( )
| A. | 碳氢原子个数比为1:3的烃有两种 | |
| B. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| C. | 丙烷分子中的3个碳原子一定在同一平面上,丁烷分子中的4个碳原子不一定 | |
| D. | 常温下,液态烷中仅有一种一氯代物的只有新戊烷 |
11.有机化合物A(C9H10O2)为一种无色液体.从A出发可发生如图的一系列反应.则下列说法正确的是( )
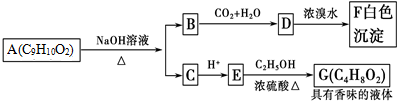

| A. | 根据图示可推知D为苯酚 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有两种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | A的结构中含有碳碳双键 |
 ;
;