题目内容
8.下列叙述不正确的是( )| A. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有6种 | |
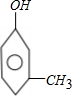
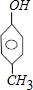
| B. | 与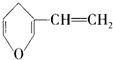 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 | |
| C. | 已知丁基共有四种.不必试写,立即可断定分子式为C5H10O的醛应有4种 | |
| D. | 菲的结构简式为 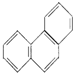 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 |
分析 A.根据等效H可知甲苯苯环上有3种H原子,含3个碳原子的烷基有正丙基、异丙基两种,据此计算判断;
B、同分异构体的芳香族化合物,说明是含有苯环结构的同分异构体,根据结构可知该有机物不饱和度为4,只含有1个苯环,苯环的不饱和度为4,所以侧链不存在不饱和键;
C、C5H10O是醛,含有醛基,即-CHO,C5H10O可以看做丁基代替HCHO中的H原子,所以,丁基有几种,C5H10O就有几种同分异构体;
D、根据分子中等效氢原子判断,分子中有几种氢原子其一硝基取代产物就有几种,苯环是平面正六边形,菲具有很高的对称性,利用对称判断分子中等效H原子种数.
解答 解:A.甲苯苯环上有3种H原子,含3个碳原子的烷基有正丙基、异丙基两种,所以甲苯苯环上的一个氢原子被含3个碳原子的烷基取代有3×2=6产物,故A正确;
B、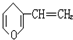 分子式为C7H8O.若只有1个侧链,含有苯环的同分异构体有
分子式为C7H8O.若只有1个侧链,含有苯环的同分异构体有 ,
,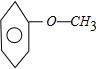 共2中.若有2个侧链,含有苯环同分异构体有
共2中.若有2个侧链,含有苯环同分异构体有 ,
, ,
, 共3种,所以含有苯环同分异构体有5种,故B错误;
共3种,所以含有苯环同分异构体有5种,故B错误;
C、C5H10O是醛,含有醛基,即-CHO,C5H10O可以看做丁基代替HCHO中的H原子,丁基有四种,所以C5H10O就有四种同分异构体,故C正确;
D、苯环是平面正六边形,菲具有很高的对称性,沿如图虚线对称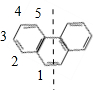 ,有如图所示5种H原子,故菲的一硝基取代物有5种,故D正确.
,有如图所示5种H原子,故菲的一硝基取代物有5种,故D正确.
故选B.
点评 本题考查有机物的同分异构体的书写知识,注意等效氢的判断方法以及类别异构的书写是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.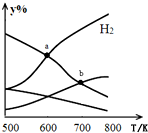 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
19.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
| A. | 丙烷与氯气在光照条件下生成氯丙烷 | |
| B. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| C. | 乙烯与水反应生成乙醇 | |
| D. | 乙烯自身聚合生成聚乙烯 |
16.元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素原子的外围电子排布为ns(n-1)np(n+1),
则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
3.下列物质属于互为同分异构体关系的是( )
| A. | 丁烯和丁二烯 | B. | 丙醛和丙酮 | C. | 乙醇和乙醚 | D. | 丙二醇和丙三醇 |
13.有关有机物分子结构或构型的判断,正确的是( )
| A. | 碳氢原子个数比为1:3的烃有两种 | |
| B. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| C. | 丙烷分子中的3个碳原子一定在同一平面上,丁烷分子中的4个碳原子不一定 | |
| D. | 常温下,液态烷中仅有一种一氯代物的只有新戊烷 |
20.在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )
| A. | v(N2)=0.1mol•L-1•s-1 | B. | v(H2)=0.1mol•L-1•min-1 | ||
| C. | v(NH3)=0.15mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
17.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.你的解释是Mn2+的3d轨道电子排布为半满状态较稳定.
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子间存在氢键,与水分子可形成氢键.
(1)写出F原子的电子排布式1s22s22p63s23p63d64s2,F位于周期表第VIII族.
(2)A、B、C的第一电离能由小到大的顺序为C<O<N.
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
| 元 素 | M | F | |
| 电能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为8,一个晶胞中F原子的数目为2.
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
18.能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙二醇和水 | ||
| C. | NaCl溶液和高级脂肪酸 | D. | 饱和Na2CO3溶液和乙酸乙酯 |