题目内容
12. 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.(1)生成物NF3中氮原子的轨道杂化方式为sP3,NF3分子空间构型为三角锥;键角小于 109°28′(填“大于”“小于”“等于”).
(2)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式CO2或N2O.
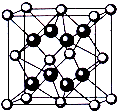
(3)某元素X跟氟可形成离子晶体,其晶胞结构如上图,该离子化合物的化学式为(用X、F表示)XF2;X阳离子的配位数为8.
(4)若晶胞边长为a cm,该离子化合物的摩尔质量为M g/mol,则该晶体的密度为(用a、M、NA 表达)$\frac{4M}{{a}^{3}{N}_{A}}$ g•cm-3.
分析 (1)根据分子中δ键和孤电子对数判断杂化类型和分子的空间构型;由于三角锥形中孤电子对的排斥作用大于成键电子对,使键角变小;
(2)N3-含有3个原子和22个电子,结合等电子体的定义分析;
(3)F原子在晶胞内部,X在顶点和面心上,利用均摊法计算化学式;根据X阳离子连接的氟离子的个数判断;
(4)晶胞平均含有4个X,8个F-,其质量为$\frac{4M}{{N}_{A}}$g,结合ρ=$\frac{m}{V}$计算.
解答 解:(1)NF3中含有3个δ键,且孤电子对数为$\frac{5-3}{2}$=1,则应为sp3杂化,空间构型为三角锥形,由于三角锥形中孤电子对的排斥作用大于成键电子对,使键角变小,所以NF3的键角小于109°28′;
故答案为:sp3;三角锥形;小于;
(2)N3-含有3个原子和22个电子,价电子总数为16,则对应的等电子体有CO2或CS2、N2O等,故答案为:N2O或CO2;
(3)F原子在晶胞内部,晶胞中含有8个F,X在顶点和面心上,则X的个数为$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,则该离子化合物的化学式为XF2;在面心的X原子该晶胞中连接4个氟离子,而且X为两个晶胞共用,所以X的配位数为8;
故答案为:XF2;8;
(4)晶胞平均含有4个X,8个F-,其质量为$\frac{4M}{{N}_{A}}$g,该离子化合协晶体的体积为a3 g/cm3,则晶胞的密度是$\frac{4M}{{a}^{3}{N}_{A}}$g•cm3,故答案为:$\frac{4M}{{a}^{3}{N}_{A}}$.
点评 本题考查较为综合,涉及杂化类型、空间构型、等电子体、晶胞的计算,侧重于知识的掌握与迁移的考查,注意把握晶胞的计算方法,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |
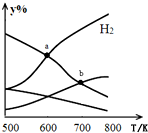 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
(3)实验时可观察到装置①A瓶的溶液褪色,C瓶的溶液不褪色.试回答:A瓶溶液的作用是验证产物气流中有SO2,B瓶中反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(5)装置③中所盛溶液是澄清石灰水,正确的现象是变浑浊.
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
 .
. .
.