题目内容
16.写出下列物质的形成过程:CaCl2

H2O
 .
.
分析 氯化钙是离子化合物,其阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可,离子都满足8电子稳定结构,并用箭头表示电子转移;
H2O为共价化合物,在用电子式表示形成过程时不能标示电子的转移,据此分析.
解答 解:氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为
,H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,
,
故答案为: ;
; .
.
点评 本题考查用电子式的形成过程,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
13.下列化合物中,既有离子键,又有非极性键的是( )
| A. | Na2O | B. | Ba(OH) 2 | C. | H2SO4 | D. | Na2O2 |
4.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象完成下列问题:
(1)实验①、②的Al所作的电极分别是d(填序号)
a.负极,负极 b.正极,正极
c.负极,正极 d.正极,负极
(2)写出实验③中的电极反应式:铝电极:2Al-6e-═2Al3+,石墨电极:6H++6e-═3H2↑.
(3)对比实验①和②,以及①和④中的电流计指针偏转方向,总结在原电池中电极作正极还是负极受哪些因素影响两个电极的相对活泼性;电解质溶液的酸碱性
(4)解释实验⑤中,电流计指针偏向铝的原因Al钝化作正极,铜易失电子作负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg Al | 稀盐酸 | 偏向Al |
| ② | Al Cu | 稀盐酸 | 偏向Cu |
| ③ | Al 石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al Cu | 浓硝酸 | 偏向Al |
(1)实验①、②的Al所作的电极分别是d(填序号)
a.负极,负极 b.正极,正极
c.负极,正极 d.正极,负极
(2)写出实验③中的电极反应式:铝电极:2Al-6e-═2Al3+,石墨电极:6H++6e-═3H2↑.
(3)对比实验①和②,以及①和④中的电流计指针偏转方向,总结在原电池中电极作正极还是负极受哪些因素影响两个电极的相对活泼性;电解质溶液的酸碱性
(4)解释实验⑤中,电流计指针偏向铝的原因Al钝化作正极,铜易失电子作负极,所以电流计指针偏向铝.
11. 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(1)除如图装置所示的实验用品外,还需要的一件实验用品是秒表.
(2)圆底烧瓶中反应现象:溶液变浑浊,并有刺激性气体产生,写出所发生反应的离子方程式为S2O32-+2H+═H2O+S↓+SO2↑.
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水.
(4)利用该化学反应,试简述测定反应速率的其他方法:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度)(写一种).Ⅱ.探究化学反应速率的影响因素为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表.(已知 I2+2S2O${\;}_{3}^{2-}$═S4O${\;}_{6}^{2-}$+2I-,其中Na2S2O3溶液均足量)
(5)表中Vx=4mL,T1、T2、T3的大小关系是T1<T2<T3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(1)除如图装置所示的实验用品外,还需要的一件实验用品是秒表.
(2)圆底烧瓶中反应现象:溶液变浑浊,并有刺激性气体产生,写出所发生反应的离子方程式为S2O32-+2H+═H2O+S↓+SO2↑.
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水.
(4)利用该化学反应,试简述测定反应速率的其他方法:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度)(写一种).Ⅱ.探究化学反应速率的影响因素为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表.(已知 I2+2S2O${\;}_{3}^{2-}$═S4O${\;}_{6}^{2-}$+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
1.几种短周期元素的原子半径及主要化合价见表:
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:Y>R>X | |
| D. | 气态氢化物的稳定性:Z>T |
8.有机化合物A的分子量为100,其中碳的质量分数为60%,氢的质量分数为8%,其余为氧,那么A的分子式是( )
| A. | C7H16 | B. | C5H8O2 | C. | C4H4O3 | D. | C6H12O |
5.下列各组物质属于同分异构体的是( )
| A. | 丁烷与丁烯 | B. | 乙醇与乙醚 | ||
| C. | 丙醛与丙酮 | D. | 2,2-二甲基丙烷与新戊烷 |
6.将如图所示实验装置的K闭合,下列判断正确的是( )
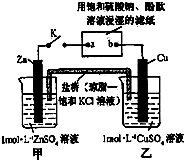

| A. | 片刻后可观察到滤纸a点变红色 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 盐桥中的Cl-向Cu极移动 |