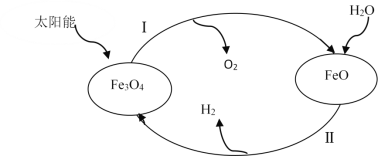
题目内容
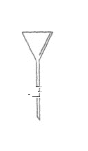
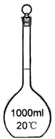
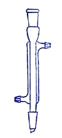
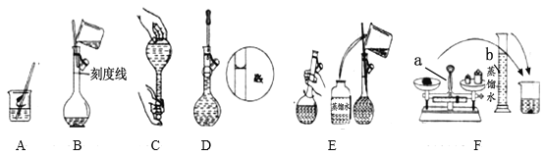
【题目】I.下面是几种实验中常用的仪器:
|
|
|
|
A | B | C | D |
写出序号所代表的仪器的名称:B___________;C___________;D___________。
II.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制490 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时仰视观察凹液面。________________
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。________________
③该同学取他所配制的0.400 mol·L-1的盐酸去中和含0.4 g NaOH的NaOH溶液,结果发现所取盐酸的体积比所计算的25mL要小,则可能的原因是________
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
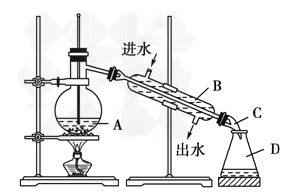
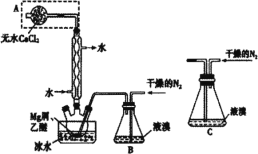
(5)实验过程中用到蒸馏水。如右图为实验室制取蒸馏水的装置示意图。请改正图中的两处明显的错误:________________;________________。实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是__________。
【答案】1000ml容量瓶 冷凝管 分液漏斗 11.9 B、D B、C、D 16.8mL 偏大 偏小 C 温度计的水银球应在蒸馏烧瓶支管口处 冷凝器应为下口进水,上口出水 防止暴沸
【解析】
I.仪器的名称为 1000mL容量瓶,冷凝管 ,分液漏斗;
II.(1)根据c=![]() 计算该浓盐酸中HCl的物质的量浓度;
计算该浓盐酸中HCl的物质的量浓度;
(2)根据该物理量是否与溶液的体积有关判断;
(3)A.根据容量瓶的使用方法;
B.根据容量瓶用蒸馏水洗净后,再用待配液润洗,待配液中含有溶质;
C.根据容量瓶不能直接用来溶解固体;
D.根据容量瓶不能直接用来稀释溶液;
E.根据定容后,需将溶液摇匀;
(4)①根据溶液稀释定律前后所含溶质的物质的量不变计算;
②分析操作对溶质的物质的量和溶液的体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
③根据关系式:HCl~NaOH计算;盐酸体积减少,说明标准液盐酸体积读数减小,逐项分析即可;
(5)实验室用自来水制取蒸馏水用蒸馏的方法制备,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用。
I.仪器的名称B为1000mL容量瓶,C为冷凝管 ,D为分液漏斗,
故答案为1000mL容量瓶;冷凝管;分液漏斗;
II. (1)质量分数36.5%,密度为1.19g/mL的盐酸的物质的量浓度=![]() =
=![]() =11.9mol/L,
=11.9mol/L,
故答案为11.9;
(2)A.溶液中HCl的物质的量=cV,所以与溶液的体积有关,故A不符合题意;
B. 溶液具有均一性,浓度与溶液的体积无关,故B符合题意;
C. 溶液中Cl的数目=nNA=cVNA,所以与溶液的体积有关,故C不符合题意;
D. 溶液的密度与溶液的体积无关,故D符合题意;
故答案选BD;
(3)A.配制溶液时要摇匀,应检验容量瓶是否漏液,故A正确;
B. 容量瓶用水洗净后,不能用待配溶液洗涤,否则会引起溶质的物质的量偏多,则所配溶液浓度偏大,故B错误;
C. 容量瓶为精密仪器,不能用来溶解固体,故C错误;
D. 容量瓶为精密仪器,不能用来稀释浓溶液,故D错误;
E. 盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选BCD;
(4)①配制490mL物质的量浓度为0.400molL1的稀盐酸,应选择500mL容量瓶,设需要的浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可得:11.9mol/L×VmL=0.4mol/L×500mL,解得V=16.8mL;
故答案为16.8 mL;
②a.用量筒量取浓盐酸时仰视观察凹液面,导致量取的氯化氢的物质的量偏大,溶液浓度偏大,
故答案为偏大;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。导致溶液的体积偏大,故浓度偏小,
故答案为偏小;
③由关系式:HClNaOH可知:n(HCl)=n(NaOH)=![]() =0.01mol,V(HCl)=
=0.01mol,V(HCl)=![]() =0.025L=25mL,消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,
=0.025L=25mL,消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,
a、浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故a不符合题意;
b、配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故b不符合题意;
c、配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故c符合题意;
d、加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故d不符合题意;
故答案为c;
(5)温度计水银球应处在蒸馏烧瓶的支管口附近;冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用;蒸馏时烧瓶内要加沸石,目的是防止暴沸,
故答案为温度计水银球应位于蒸馏烧瓶的支管处;冷凝器应为下口进水,上口出水;防止暴沸。

 名校课堂系列答案
名校课堂系列答案【题目】乳酸亚铁([CH3CH(OH)COO]2Fe3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe3H2O+CO2↑
FeCO3不溶于水,易被氧化,4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图:
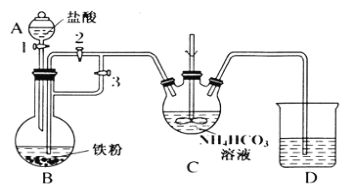
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式_________。
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_____。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。加入少量铁粉的作用是_______。
(4)反应结束后,无需过滤,除去过量铁粉的方法是_________。
(5)从所得溶液中获得乳酸亚铁晶体的方法是:________,冷却结晶,过滤, 用适量乙醇洗涤,干燥。
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是___。
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+=Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500molL-1Ce(SO4)2标准溶液滴定至终点,记录数据如表。
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.20 | 19.95 |
2 | 0.10 | 21.65 |
3 | 0.95 | 20.60 |
则产品中乳酸亚铁的质量分数为________%。(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+:_______。