题目内容
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如图所示。
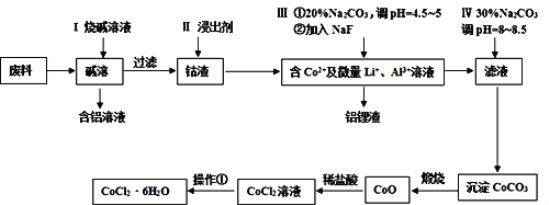
请回答下列问题:
(1)步骤I中发生反应的化学方程式_______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果_______;若步骤II中浸出剂为硫酸,写出Co2O3与硫酸反应的化学方程式______。
(3)步骤Ⅲ中①的目的是除去Al3+,②的目的是除去Li+,写出除去Li+的离子方程式_______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_______、过滤、洗涤、干燥。用75%酒精代替蒸馏水洗涤,其优点是______。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Li+2H2O=2LiOH+H2↑ 产生有毒气体氯气,污染环境 2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O Li++F-=LiF↓ 坩埚 泥三角 蒸发浓缩 冷却结晶 减少晶体的溶解损失,酒精挥发带走水分
【解析】
根据流程:含钴废料(含CoO、Co2O3、单质Al、Li等)加入烧碱溶液溶解,其中Al、Li可以溶解:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Li+2HO+2LiOH+H2↑,过滤除去滤液,得到含钴的滤渣,加入浸出剂浸取钴,得到含有Co2+、Al3+、Li+的溶液,加入碳酸钠溶液调节pH为4.5~5沉淀Al3+:2Al3++3CO32-+2H2O=2Al(OH)3↓+3CO2↑,再加入NaF沉淀Li+,除去铝锂沉淀,向滤液中加碳酸钠调节pH8~8.5,沉淀Co2+,得到CoCO3,灼烧CoCO3得到CoO,用稀盐酸溶解得到CoCl2溶液,将溶液在HCl氛围中,蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CoCl26H2O,据此分析作答。
(1)步骤I为含钴废料(含CoO、Co2O3、单质Al、Li等)与NaOH溶液混合,Al与NaOH溶液反应,Li与水反应,反应分别为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Li+2H2O=2LiOH+H2↑;
(2)Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,Co2O3将盐酸氧化生成氯气,氯气有毒,会污染空气;若步骤II中浸出剂为硫酸,Co2O3与硫酸会发生氧化还原反应产生CoSO4、O2和H2O,反应的化学方程式为:2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O;
(3)步骤Ⅲ中①加入碳酸钠溶液调节pH为4.5~5除去Al3+,离子反应为:2Al3++3CO32-+2H2O=2Al(OH)3↓+3CO2↑;②的目的是除去Li+,除去Li+的离子方程式为:Li++F-=LiF↓;
(4)在实验室煅烧CoCO3,所需的硅酸盐质仪器除了有酒精灯、玻璃棒外,还有坩埚、泥三角;
(5)操作①是从CoCl2溶液中结晶CoCl26H2O,由于CoCl2是强酸弱碱盐,Co2+容易水解,且水解产生的HCl容易挥发导致物质变质,所以从溶液中获得该物质晶体的具体操作为:将溶液在HCl氛围中,蒸发浓缩、冷却结晶、过滤、洗涤、干燥;洗涤过程中可以用75%酒精代替水,这样就可以减少晶体的溶解损失,且酒精挥发会带走水分。

【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) ![]() N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH
若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1)则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) ![]() N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
(3) 关于合成氨工艺的理解,下列正确的是________。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
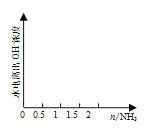
(4) 在1 L 1 mol·L1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH浓度随氨气通入变化的趋势图。______________________________
(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
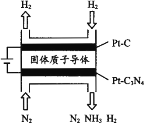
①PtC3N4电极反应产生NH3的电极反应式________。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因________。
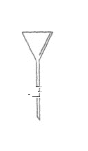
【题目】I.下面是几种实验中常用的仪器:
|
|
|
|
A | B | C | D |
写出序号所代表的仪器的名称:B___________;C___________;D___________。
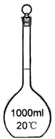
II.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制490 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时仰视观察凹液面。________________
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。________________
③该同学取他所配制的0.400 mol·L-1的盐酸去中和含0.4 g NaOH的NaOH溶液,结果发现所取盐酸的体积比所计算的25mL要小,则可能的原因是________
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
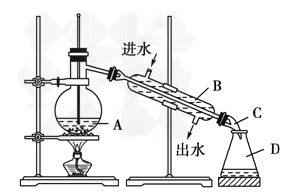
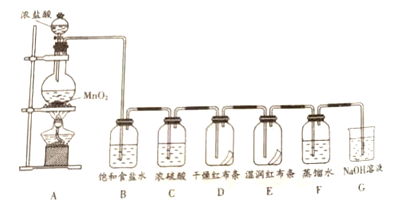
(5)实验过程中用到蒸馏水。如右图为实验室制取蒸馏水的装置示意图。请改正图中的两处明显的错误:________________;________________。实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是__________。