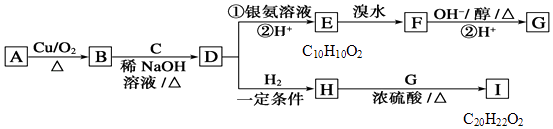
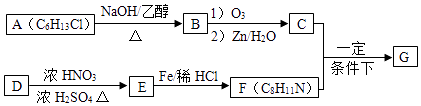
题目内容
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
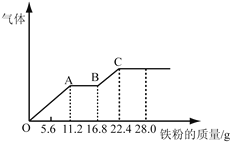
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
【答案】C
【解析】试题分析:某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。由铜与稀硝酸反应的离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,n(HNO3)=![]() 。由图可知,向另一份中逐渐加入铁粉, OA段发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,n(Fe)= n(Fe3+)= n(HNO3)=
。由图可知,向另一份中逐渐加入铁粉, OA段发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,n(Fe)= n(Fe3+)= n(HNO3)=![]() ;AB段的反应为Fe+2Fe3+=3Fe2+,这阶段溶解的铁的物质的量为
;AB段的反应为Fe+2Fe3+=3Fe2+,这阶段溶解的铁的物质的量为![]() n(Fe3+)=0.1mol;BC段又产生气体,故此阶段的反应为Fe+2H+= Fe2++H2↑。A. 混合酸中HNO3物质的量浓度为
n(Fe3+)=0.1mol;BC段又产生气体,故此阶段的反应为Fe+2H+= Fe2++H2↑。A. 混合酸中HNO3物质的量浓度为![]() 2mol/L。A正确;B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B正确;C. 由图像可知,每份混酸最多可溶解22.4gFe生成FeSO4溶液,由Fe守恒可知,原混合酸中H2SO4物质的量等于铁的物质的量的2倍(因为共分为2等份),即
2mol/L。A正确;B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B正确;C. 由图像可知,每份混酸最多可溶解22.4gFe生成FeSO4溶液,由Fe守恒可知,原混合酸中H2SO4物质的量等于铁的物质的量的2倍(因为共分为2等份),即![]() =0.8 mol,C不正确;D. 第二份溶液中最终溶质为FeSO4,D正确。本题选C。
=0.8 mol,C不正确;D. 第二份溶液中最终溶质为FeSO4,D正确。本题选C。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目