题目内容
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
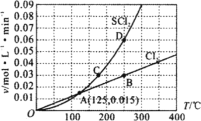
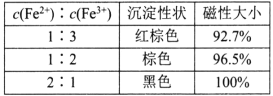
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。检验溶液中还存在Fe2+的方法是___。写出②过程的离子方程式:____。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。检验溶液中还存在Fe2+的方法是___。写出②过程的离子方程式:____。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___。
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的总反应方程式为___。
(3)已知:H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
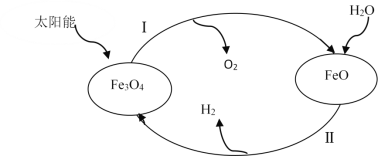
过程I.____,
过程II:3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
【答案】取少量溶液,滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色(或取少量溶液,加入铁氰酸钾,生成蓝色沉淀(KFe[Fe(CN)6]) Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O Fe2+容易被氧化为Fe3+ 3Fe+4H2O(g)![]() Fe3O4+4H2 2Fe3O4(s)=6FeO(s)+O 2(g)ΔH3=+313.2kJ·mol-1(或Fe3O4(s)=3FeO(s)+
Fe3O4+4H2 2Fe3O4(s)=6FeO(s)+O 2(g)ΔH3=+313.2kJ·mol-1(或Fe3O4(s)=3FeO(s)+![]() O2(g)ΔH3=+156.6kJ·mol-1)
O2(g)ΔH3=+156.6kJ·mol-1)
【解析】
(1)Fe2+具有还原性,能还原酸性高锰酸钾;②过程中Fe2+和Fe3+的物质的量比为1:2的溶液加入氨水,生成Fe3O4;Fe2+容易被氧化为Fe3+,生产过程中部分Fe2+可能被氧气氧化;
(2)根据题意,不锈钢小球作阳极,制备纳米级Fe3O4,Fe3O4是阳极产物,阴极氢离子得电子生成氢气。
(3)由图示可知,过程I是Fe3O4分解为FeO和氧气,根据盖斯定律计算焓变;
(1)Fe2+具有还原性,能还原酸性高锰酸钾,检验溶液中还存在Fe2+的方法是:取少量溶液,滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色;②过程中Fe2+和Fe3+的物质的量比为1:2的溶液加入氨水,生成Fe3O4,反应的离子方程式是Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O;Fe2+容易被氧化为Fe3+,生产过程中部分Fe2+可能被氧气氧化,所以当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,产品磁性最大;
(2)根据题意,不锈钢小球作阳极,制备纳米级Fe3O4,Fe3O4是阳极产物,阳极反应式是3Fe-8e-+8OH-= Fe3O4+4H2O;阴极氢离子得电子生成氢气,阴极反应式是2H2O+2e-=H2+2OH-;总反应式是3Fe+4H2O(g)![]() Fe3O4+4H2 ;
Fe3O4+4H2 ;
(3)①H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,
O2(g)△H=+285.5kJ·mol-1,
②3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
根据盖斯定律,①×2-②×2得2Fe3O4(s)=6FeO(s)+O 2(g)ΔH3=+313.2kJ·mol-1;

【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。
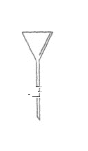
【题目】I.下面是几种实验中常用的仪器:
|
|
|
|
A | B | C | D |
写出序号所代表的仪器的名称:B___________;C___________;D___________。
II.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
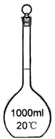
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制490 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时仰视观察凹液面。________________
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。________________
③该同学取他所配制的0.400 mol·L-1的盐酸去中和含0.4 g NaOH的NaOH溶液,结果发现所取盐酸的体积比所计算的25mL要小,则可能的原因是________
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
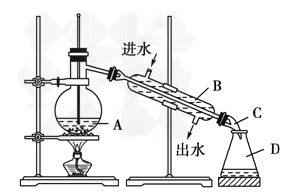
(5)实验过程中用到蒸馏水。如右图为实验室制取蒸馏水的装置示意图。请改正图中的两处明显的错误:________________;________________。实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是__________。