题目内容
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe3H2O+CO2↑
FeCO3不溶于水,易被氧化,4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图:
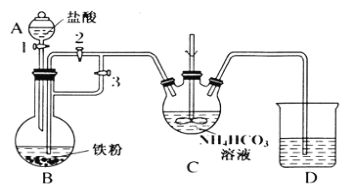
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式_________。
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_____。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。加入少量铁粉的作用是_______。
(4)反应结束后,无需过滤,除去过量铁粉的方法是_________。
(5)从所得溶液中获得乳酸亚铁晶体的方法是:________,冷却结晶,过滤, 用适量乙醇洗涤,干燥。
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是___。
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+=Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500molL-1Ce(SO4)2标准溶液滴定至终点,记录数据如表。
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.20 | 19.95 |
2 | 0.10 | 21.65 |
3 | 0.95 | 20.60 |
则产品中乳酸亚铁的质量分数为________%。(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+:_______。
【答案】Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 关闭活塞3,打开活塞2 防止Fe2+被氧化 加适量的乳酸,让铁粉反应完全 隔绝空气,低温蒸发 乳酸根中羟基被高锰酸钾溶液氧化(或者乳酸根被高锰酸钾溶液氧化;或者是晶体失去了部分结晶水) 98.5 取少量乳酸亚铁补铁剂于试管中加蒸馏水溶解,滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,证明补铁剂中含Fe2+
【解析】
I.在B装置中用Fe与盐酸反应制备FeCl2,利用反应生成的H2排尽装置中的空气,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;在C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,
II.乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,导致所得乳酸亚铁的质量偏大;
(7)根据离子方程式Ce4++Fe2+=Ce3++Fe3+计算20mL溶液中n(Fe2+),进而计算100mL含有n(Fe2+),再根据m=n·M计算乳酸亚铁晶体的质量,进而计算产品中乳酸亚铁晶体的质量分数。
(8)根据Fe2+不能使KSCN溶液变红色,Fe3+能使KSCN溶液变红色,用氧化剂将Fe2+氧化为Fe3+检验Fe2+。
(1)在装置B中Fe与HCl反应产生FeCl2和H2,反应方程式为:Fe+2HCl=FeCl2+H2↑,利用反应生成的氢气排尽装置中的空气,并将FeCl2溶液压入C装置中,在C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,该反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是关闭活塞3,打开活塞2,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化;
(4)反应结束后,无需过滤,除去过量铁粉的方法是利用乳酸具有酸性,可以与过量的Fe粉反应产生乳酸亚铁,从而使过量的铁粉可以充分利用;
(5)从所得溶液乳酸亚铁中获得乳酸亚铁晶体的方法是隔绝空气,低温蒸发溶剂,然后经过冷却结晶、过滤、用适量乙醇洗涤、干燥等操作;
(6)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,因此会使计算所得乳酸亚铁的质量偏大,导致产品中乳酸亚铁的质量分数会大于100%;
(7)三次滴定第二次操作消耗标准液数值明显偏大,应舍去,根据第一次和第三次平均值V=![]() mL=19.70mL,由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.0500mol/L×0.0197L=0.000985mol,所以100mL含有n(Fe2+)=0.000985mol×
mL=19.70mL,由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.0500mol/L×0.0197L=0.000985mol,所以100mL含有n(Fe2+)=0.000985mol×![]() =0.004925mol,则产品中乳酸亚铁晶体的质量分数为
=0.004925mol,则产品中乳酸亚铁晶体的质量分数为![]() ×100%=98.5%;
×100%=98.5%;
(2)可根据Fe2+与SCN-混合物明显现象,加入氧化剂将Fe2+氧化为Fe3+后溶液变为血红色检验Fe2+的存在,故设计实验证明购买的乳酸亚铁补铁剂中含Fe2+的方法是取少量乳酸亚铁补铁剂于试管中,加蒸馏水溶解,滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,证明补铁剂中含Fe2+。

【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) ![]() N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH
若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1)则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) ![]() N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
(3) 关于合成氨工艺的理解,下列正确的是________。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
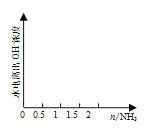
(4) 在1 L 1 mol·L1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH浓度随氨气通入变化的趋势图。______________________________
(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
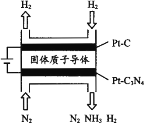
①PtC3N4电极反应产生NH3的电极反应式________。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因________。
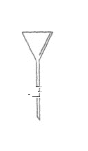
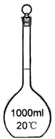
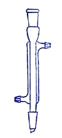
【题目】I.下面是几种实验中常用的仪器:
|
|
|
|
A | B | C | D |
写出序号所代表的仪器的名称:B___________;C___________;D___________。
II.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制490 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时仰视观察凹液面。________________
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。________________
③该同学取他所配制的0.400 mol·L-1的盐酸去中和含0.4 g NaOH的NaOH溶液,结果发现所取盐酸的体积比所计算的25mL要小,则可能的原因是________
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
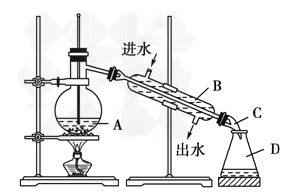
(5)实验过程中用到蒸馏水。如右图为实验室制取蒸馏水的装置示意图。请改正图中的两处明显的错误:________________;________________。实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是__________。
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关