题目内容
11. 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.(1)硫酸亚铁是一种常见的补血剂,但很容易被氧化.若需证明Fe2+是否全部被氧化,可以选择的试剂是酸性高锰酸钾溶液;若向硫酸亚铁溶液中加入双氧水和稀硫酸,现象是溶液由浅绿色变为棕黄色,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
(2)在空气中强热硫酸亚铁有SO2和SO3气体产生,同时生成红褐色固体,请选择合适的下列仪器(见图)设计实验收集产生的SO2和SO3气体,连接顺序为BDC(用装置下的字母表示)
(3)常用的干燥剂硅胶,是网状多孔物质,主要成分为SiO2,其中含水约为4%,制法是将硅酸减压条件下加热到300℃,使之分解.现以石英、纯碱、盐酸为原料,生产硅胶,试按生产顺序写出各步反应的化学方程式SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、Na2SiO3+2HCl=H2SiO3↓+2NaCl、H2SiO3 $\frac{\underline{\;加热\;}}{减压}$ SiO2+H2O.
分析 (1)利用亚铁离子具有还原性设计实验验证,加入高锰酸钾溶液不褪色证明不含亚铁离子;向硫酸亚铁溶液中加入双氧水和稀硫酸,硫酸亚铁被氧化为硫酸铁溶液;
(2)设计实验收集产生的SO2和SO3气体,利用三氧化硫熔点低冷却会凝结为晶体,二氧化硫是比空气重的易溶于水的气体,用向上排气法收集;
(3)以石英、纯碱、盐酸为原料,生产硅胶,二氧化硅和碳酸钠加热反应生成硅酸钠,硅酸钠和和盐酸反应生成硅酸,硅酸分解得到二氧化硅;
解答 解:(1)利用亚铁离子具有还原性设计实验验证,加入高锰酸钾溶液不褪色证明不含亚铁离子;向硫酸亚铁溶液中加入双氧水和稀硫酸,硫酸亚铁被氧化为硫酸铁溶液,溶液由浅绿色变化为棕黄色,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:酸性高锰酸钾溶液,溶液由浅绿色变为棕黄色,2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)设计实验收集产生的SO2和SO3气体,利用三氧化硫熔点低冷却会凝结为晶体,二氧化硫是比空气重的易溶于水的气体,用向上排气法收集,剩余气体有毒污染空气需要用氢氧化钠溶液吸收,所以选择的装置顺序为BDC,
故答案为:BDC;
(3)以石英、纯碱、盐酸为原料,生产硅胶,二氧化硅和碳酸钠加热反应生成硅酸钠,SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,硅酸钠和和盐酸反应生成硅酸,Na2SiO3+2HCl=H2SiO3↓+2NaCl,硅酸分解得到二氧化硅H2SiO3 $\frac{\underline{\;加热\;}}{减压}$ SiO2+H2O;
故答案为:SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,Na2SiO3+2HCl=H2SiO3↓+2NaCl,H2SiO3 $\frac{\underline{\;加热\;}}{减压}$ SiO2+H2O;
点评 本题考查了物质性质,物质制备分析,离子检验方法,离子方程式书写,掌握基础是解题关键,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案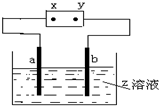 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) | a极板 | b极板 | x电极 | Z溶液 | |
| A | 铜 | 银 | 负极 | CuCl2 |
| B | 石墨 | 石墨 | 正极 | NaOH |
| C | 铁 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 银 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | -NH2 | B. | -CHO | C. | -COOH | D. | -CH2CH3 |
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
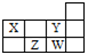
| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |

这些模型的历史演变顺序是( )
| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
