题目内容
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
分析 A、依据n=$\frac{N}{{N}_{A}}$计算物质的量=1mol,结合NO2和CO2混合气体中都含有2个氧原子计算;
B、乙烯和环丁烷最简式相同为CH2;
C、NO2和N2O4最简式相同为NO2,计算92gNO2中所含原子数;
D、常温常压下,不能用22.4L/mol来计算氯气的物质的量.
解答 解:A、依据n=$\frac{N}{{N}_{A}}$计算物质的量=1mol,结合NO2和CO2混合气体中都含有2个氧原子计算,混合气体中含有的氧原子数为2NA,故A正确;
B、乙烯和环丁烷最简式相同为CH2,28gCH2所含的碳原子数=$\frac{28g}{14g/mol}$×1×NA=2NA,故B正确;
C、NO2和N2O4最简式相同为NO2,计算92gNO2中所含原子数=$\frac{92g}{46g/mol}$×3×NA=6NA,故C正确;
D、常温常压下,不能用22.4L/mol来计算氯气的物质的量,故D错误.
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
5.某有机物A的结构简式如图所示,它是一种营养增补剂,存在于槐树花蕾中,关于A的叙述不正确的是( )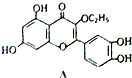

| A. | A的分子式为C17H14O7 | |
| B. | 一个A分子中含有三个苯环且A分子中无手性碳原子 | |
| C. | A可用有机溶剂萃取 | |
| D. | 1molA与足量的NaOH 溶液反应,最多可以消耗4molNaOH |
6.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
3.四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
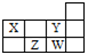

| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |
10.某一化学反应在0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
5.位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,又知Y原子的最外层电子数是其内层电子数的3倍,M原子的最外层上只有2个电子,Z与X位于同一主族,N与Y位于同一主族.下列叙述正确的是( )
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
6.长效阿司匹林的结构为: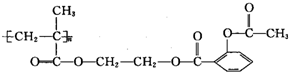 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )
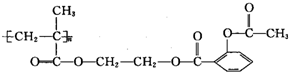 ,1mol该物质能与NaOH反应的物质的量是( )
,1mol该物质能与NaOH反应的物质的量是( )| A. | 3mol | B. | 4mol | C. | 3n mol | D. | 4n mol |

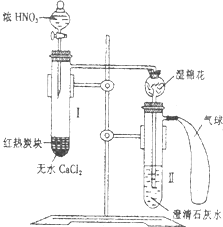 某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.
某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.