题目内容
10.有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素.①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的层电子层数:B=C=2A;④B元素的最高正价与最低负价数量之差为2,⑤F在地壳中金属含量第二,下列说法正确的是( )| A. | B的氧化物对应的水化物为强酸 | |
| B. | F单质与C单质反应的产物只有一种 | |
| C. | 因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比溴单质要低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
分析 有A、B、C、D、E、F六种元素,其中A、B、C、D、E为原子序数依次增大的短周期元素.由于原子的电子层数:B=C=2A,则A只能处于第一周期,B、C处于第二周期,B元素的最高正价与最低负价的绝对值之差为2,则B处于ⅤA族,则B为氮元素,原子的最外层电子数:A=D、C=E、A+B=C,则A、D处于ⅠA族,C最外层电子数为6,可推知C为氧元素,A为氢元素,故E为硫元素;结合原子半径:A<C<B<E<D,结合原子序数,故D为Na,F为地壳中含量第二的金属元素,则F为Fe,据此解答.
解答 解:有A、B、C、D、E、F六种元素,其中A、B、C、D、E为原子序数依次增大的短周期元素.由于原子的电子层数:B=C=2A,则A只能处于第一周期,B、C处于第二周期,B元素的最高正价与最低负价的绝对值之差为2,则B处于ⅤA族,则B为氮元素,原子的最外层电子数:A=D、C=E、A+B=C,则A、D处于ⅠA族,C最外层电子数为6,可推知C为氧元素,A为氢元素,故E为硫元素;结合原子半径:A<C<B<E<D,结合原子序数,故D为Na,F为地壳中含量第二的金属元素,则F为Fe,
A.B为氮元素,其氧化物对应水化物中亚硝酸为弱酸,故A错误;
B.Fe与氧气形成产物有氧化亚铁、氧化铁、四氧化三铁,故B错误;
C.E为硫元素,常温下,其单质为固体,熔点高于溴单质,故C错误;
D.A为氢元素,D为Na,二者形成的化合物为NaH,溶于水反应生成氢氧化钠与氢气,故其水溶液呈碱性,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,D选项为易错点,中学基本不涉及金属氢化物.

练习册系列答案
相关题目
20.能用于鉴别甲烷和乙烯的试剂是( )
| A. | 盐酸 | B. | 酸性高锰酸钾溶液 | ||
| C. | NaOH溶液 | D. | CCl4 |
1.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | NH4NO3 | B. | CaF2 | C. | Na2S2 | D. | Na3N |
15.某有机原料的结构简式如图,下列有关该有机物的叙述正确的是( )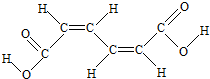

| A. | 已知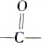 为平面结构,则该有机物分子中最多有16个原子在同一平面内 为平面结构,则该有机物分子中最多有16个原子在同一平面内 | |
| B. | 1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3 | |
| C. | 该有机物能发生加成反应不能发生取代反应 | |
| D. | 该有机物和乙酸互为同系物 |
1.如图所示能够组成原电池,并且产生明显的电流的是( )
| A. |  | B. |  | C. |  | D. |  |
2.有机物M的结构简式为: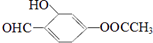 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的分子式为:C9H8O4 | |
| B. | M与乙酸苯乙酯互为同系物 | |
| C. | M可发生水解反应、加成反应、氧化反应 | |
| D. | 1mol M可与3mol NaOH和2mol Br2发生反应 |
 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题: