题目内容
18.某中 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:①甲处河水呈黄色;
②乙处河水呈红褐色浑浊状;
③丙处河水变澄清;
④丁处河水不断冒气泡;
⑤M处水样的pH>7,加足量HNO3,再加BaCl2 溶液后,无沉淀;
⑥N处水样的pH<7.
请回答下列问题:
(1)四所工厂排放的废水中,分别含下列物质的哪一种?
Fe2(SO4)3、NaOH、AgNO3 、Na2CO3 、FeCl3、H2SO4
甲FeCl3、乙NaOH、丙H2SO4、丁Na2CO3.
(2)M处河水中一定含有的物质是NaCl、NaOH.
分析 ①甲处河水呈黄色,说明含有Fe3+;M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成,说明甲处不是硫酸铁而是氯化铁,化学式为FeCl3,乙处河水呈红褐色浑浊状,显然乙处有碱性物质和Fe3+生成了Fe(OH)3,说明乙处是氢氧化钠,化学式为NaOH;丙处河水变澄清,说明丙厂废水含有H2SO4;丁处河水冒气泡,说明丁厂废水中含Na2CO3,N处水样的pH小于7,说明是丙处的硫酸过量,与丁处的碳酸钠充分反应,据此进行解答.
解答 解:甲处河水呈黄色,说明含有Fe3+;M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成,说明甲处不是硫酸铁而是氯化铁,化学式为FeCl3,乙处河水呈红褐色浑浊状,显然乙处有碱性物质和Fe3+生成了Fe(OH)3,说明乙处是氢氧化钠,化学式为NaOH,丙处河水变澄清,说明丙厂废水含有H2SO4;丁处河水冒气泡,说明丁厂废水中含Na2CO3,N处水样的pH小于7,说明是丙处的硫酸过量,与丁处的碳酸钠充分反应,
(1)根据上面的分析可知,甲为FeCl3,乙为NaOH,丙为H2SO4,丁为Na2CO3,故答案为:FeCl3;NaOH;H2SO4;Na2CO3;
(2)甲处排放的废水中含有氯化铁,乙处的废水中含有NaOH,氯化铁与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,所以M处一定含有NaCl;另外M处溶液的pH>7,说明乙处的NaOH过量,则M处的河水中还含有NaOH,故答案为:NaCl、NaOH.
点评 本题考查了未知物的检验,题目难度中等,试题以常见物质之间的离子反应为切入点,从环保的角度考查知识的实际应用,注意根据物质的颜色和溶解性进行推断.

练习册系列答案
相关题目
8.物质的量浓度都是0.1mol/L的CH3COOH和CH3COONa混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是( )
| A. | c(H+)<c(OH-) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.1mol/L |
9.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 共价化合物里,一定不存在离子键 | |
| C. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| D. | 由不同种元素组成的多原子分子里,一定只存在极性键 |
6.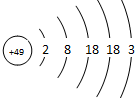 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In在反应中容易失电子 | |
| B. | In为长周期元素 | |
| C. | In的最高价氧化物对应的水化物为强碱 | |
| D. | In为过渡元素 |
13.下列关于反应速率的说法正确的是( )
| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
10.有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素.①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的层电子层数:B=C=2A;④B元素的最高正价与最低负价数量之差为2,⑤F在地壳中金属含量第二,下列说法正确的是( )
| A. | B的氧化物对应的水化物为强酸 | |
| B. | F单质与C单质反应的产物只有一种 | |
| C. | 因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比溴单质要低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
9.关于如图所示的氢氧燃料电池的说法错误的是( )


| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
10.下列各组元素性质或原子结构的递变,叙述不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |