题目内容
4.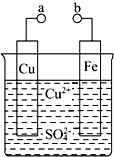 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题:(1)a和b不连接时,铁片上发生反应的离子方程式为Fe+Cu2+=Fe2++Cu,此时能量转化形式主要是化学能转化为热能.
(2)a和b用导线连接时,外电路中的电子是从Fe(填“Fe”或“Cu”)电极流出,SO42-(填“Cu2+”或“SO42-”)向负极移动,铜极发生反应的电极反应式为Cu2++2e-=Cu.
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的正极(填“正极”或“负极”)连接;此时铜片上发生的电极反应式为Cu-2e-=Cu2+.
分析 (1))a和b不连接时,会发生金属的化学腐蚀,根据化学反应知识来回答;
(2)a和b用导线连接时,形成原电池的工作原理,根据原电池的工作原理来回答;
(3)根据电镀池的工作原理来回答.
解答 解:(1))a和b不连接时,会发生金属铁的化学腐蚀,发生反应为:Fe+Cu2+=Fe2++Cu,此时化学能转化为热能,故答案为:Fe+Cu2+=Fe2++Cu;热;
(2)a和b用导线连接时,形成原电池的工作原理,此时活泼金属铁为负极,金属铜为正极,外电路中的电子是从负极流向正极,在电解质中,阳离子移向阴极,阴离子移向阳极,故答案为:Fe;SO42-;Cu2++2e-=Cu;
(3)根据电镀池的工作原理:镀层金属Cu做阳极,要和直流电源的正极相连,发生失电子的氧化反应,Cu-2e-=Cu2+,镀件Fe作阴极,发生得电子的还原反应,故答案为:正极;Cu-2e-=Cu2+.
点评 本题考查学生化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,难度不大.

练习册系列答案
相关题目
12.辛烷的分子式是( )
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C8H16 |
13.下列关于反应速率的说法正确的是( )
| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
10.有A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期元素.①原子半径:A<C<B<E<D;②原子的最外层电子数:A=D、C=E、A+B=C;③原子的层电子层数:B=C=2A;④B元素的最高正价与最低负价数量之差为2,⑤F在地壳中金属含量第二,下列说法正确的是( )
| A. | B的氧化物对应的水化物为强酸 | |
| B. | F单质与C单质反应的产物只有一种 | |
| C. | 因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比溴单质要低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
9.关于如图所示的氢氧燃料电池的说法错误的是( )


| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
16.下列说法正确的是( )
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 | |
| B. | 某放热反应在其它条件不变时,加入催化剂后反应速率加快,同时会放出更多的热量 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2 | |
| D. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
13.海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
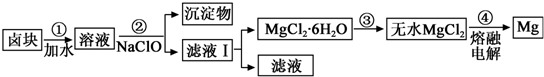
生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
14.比较下列各组物质的沸点,正确的是( )
| A. | 乙醇>丙烷 | B. | 甲烷>戊烷 | C. | 1-丁烯>1-庚烯 | D. | 乙二醇>丙三醇 |