题目内容
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
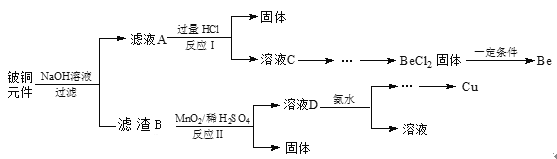
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似。
(1)氢氧化铍的电离方程式为____。
(2)滤液A的主要成分除NaOH外,还有____(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程____。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序_____。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是_____。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式______。
②若用浓HNO3溶解金属硫化物,缺点是______(任写一条)。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______。
【答案】2H++BeO22-![]() Be(OH)2
Be(OH)2![]() Be2++2OH- Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 在氯化氢的气流中蒸发结晶 MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O 产生污染环境的气体 90%
Be2++2OH- Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 在氯化氢的气流中蒸发结晶 MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O 产生污染环境的气体 90%
【解析】
废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)加入氢氧化钠溶液过滤得到滤液A为NaOH、Na2SiO3、Na2BeO2,滤液A中加入过量盐酸过滤得到固体为硅酸,滤液C主要为含NaCl、BeCl2和少量HCl,加入过量的氨水过滤,洗涤加入适量的HCl 得到氯化铍溶液,蒸发浓缩冷却结晶得到固体,一定条件下反应得到铍,滤渣B中加入二氧化锰的稀硫酸发生反应MnO2能将金属硫化物中的硫元素氧化为硫单质,过滤得到固体和滤液D,溶液D中含c(Cu2+)、c(Fe3+)、c(Mn2+),逐滴加入稀氨水调节pH可依次分离,最后经过一系列操作得到铜。
(1)氢氧化铍具有两性,可电离出OH-,也可以电离出H+,则其电离方程式为2H++BeO22-![]() Be(OH)2
Be(OH)2![]() Be2++2OH-;
Be2++2OH-;
(2)分析可知,滤液A的主要成分除NaOH外,还有:Na2SiO3、Na2BeO2,反应I中含铍化合物与过量盐酸反应的离子方程式为:BeO22-+4H+=Be2++2H2O;
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序为:加入过量的氨水过滤,洗涤加入适量的HCl,顺序为:cefd,故答案为:cefd;
②从BeCl2溶液中得到BeCl2固体时为了抑制Be2+离子的水解,需要在HCl气氛中对BeCl2溶液蒸发结晶;
(4)①MnO2能将金属硫化物中的硫元素氧化为硫单质,反应II中CuS发生反应的化学方程式为:MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O;
②浓硝酸具有氧化性做氧化剂被还原为二氧化氮、NO2气体有毒污染环境;
(5)混合物中BeO质量=1000×25%=250g,理论上得到Be的物质的量=![]() =10mol,实际得到Be物质的量=
=10mol,实际得到Be物质的量=![]() =9mol,产率=
=9mol,产率=![]() ×100%=90%。
×100%=90%。