题目内容
【题目】某化学兴趣小组的同学利用如图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:


Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与___(填装置名称)连接;装置C中的烧瓶内固体宜选用___。
a.氯化钙 b.碱石灰 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是__。
(3)装置F可用于探究氯气与氨气的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入___(填名称),然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子___,F的烧杯中所装液体为__,所起的作用是__。
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱。将装置A中产生的气体通入盛有NaBr溶液的装置E中,充分反应后取下E,加入CCl4,静置后观察到____的实验现象,则证明Br-的还原性强于Cl-。
(2)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。简述检查装置B气密性的操作____,F的烧瓶中发生反应的化学方程式为____。
【答案】球形干燥管(或干燥管) b、d 饱和食盐水、浓硫酸 氯气 取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+ NaOH溶液 吸收逸出的Cl2 装置E中的液体分层,下层液体为橙红色(或红棕色) 夹紧止水夹,向长颈漏斗加水至漏斗中的液面高于试管中的液面,静置,若液面差保持不变,则表明气密性良好 SO2+2H2S=3S+2H2O
【解析】
Ⅰ(1)氨气是碱性气体应使用碱性干燥剂,一般为碱石灰或生石灰;
(2)浓盐酸具有挥发性,制取的氯气中含有HCl和水蒸气;
(3)氨气极易溶于水,易引起倒吸,形成喷泉,氯气有颜色,会对实验现象产生干扰;氨气能使湿润的红色石蕊试纸变蓝;氯气有毒,不能排放到大气中,一般用碱液吸收;
Ⅱ(1)氯气能将溴化钠溶液中的溴离子置换出来,溴在四氯化碳中的溶解度更大,被四氯化碳萃取并分层,四氯化碳的密度比水大;
(2)检查装置B气密性的操作为:夹紧止水夹,向长颈漏斗加水至漏斗中的液面高于试管中的液面,静置,若液面差保持不变,则表明气密性良好;B生成H2S,C生成SO2,二者混合生成S和H2O。
Ⅰ(1)氨气若用装置C制取,利用的是浓氨水与吸水剂反应,注意吸水剂不能与氨气反应,可选用碱石灰或生石灰,则C与球形干燥管(或干燥管)相连,故选b、d;
(2)制取氯气的反应原理为浓盐酸与二氧化锰加热,若获得纯净、干燥的氯气,要先通过饱和食盐水吸收挥发出来的HCl,再通过浓硫酸干燥;
(3)开关3与液体相连,若先通氨气,易导致喷泉现象发生,另外,氯气为黄绿色气体,最后通氯气易干扰白烟现象的观察,故先通氯气后通氨气。NH4+的检验方法为取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;F的烧杯中所装液体为NaOH溶液,作用是吸收逸出的Cl2;
Ⅱ(1)比较Cl-和Br-的还原性强弱,可利用其对应单质间的置换反应,即氯气能将溴化钠溶液中的溴离子置换出来生成溴单质,在加入四氯化碳,溴在四氯化碳中的溶解度更大,被四氯化碳萃取并分层,四氯化碳的密度比水大,则现象为:装置E中的液体分层,下层液体为橙红色(或红棕色);
(2)检查装置B气密性的操作为:夹紧止水夹,向长颈漏斗加水至漏斗中的液面高于试管中的液面,静置,若液面差保持不变,则表明气密性良好;B生成H2S,C生成SO2,二者混合生成S和H2O,化学方程式为SO2+2H2S=3S+2H2O。

【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
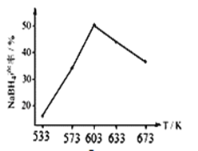
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
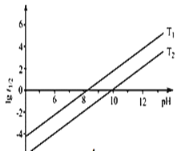
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)