题目内容
【题目】标准状况下,在干燥的烧瓶中充满纯净的NH3,进行如图所示的喷泉实验,下列说法错误的是
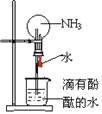
A.本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差
B.若烧瓶的氨气中混有少量空气,则喷泉实验后的水不能充满烧瓶
C.本实验若将NH3换成HCl,也能产生红色的喷泉
D.实验结束后,烧瓶中氨水的物质的量浓度为![]() mol/L。
mol/L。
【答案】C
【解析】
A.氨气极易溶于水,从而导致烧瓶内外存在压强差,使烧瓶内气压迅速小于大气压,所以形成喷泉,A正确;
B.若烧瓶的氨气中混有少量空气,由于空气中的氮气不溶于水,也不与水反应,则喷泉实验后的水不能充满烧瓶,B正确;
C.若将NH3换成HCl,HCl也极容易溶于水,由于HCl的水溶液显酸性,所以滴有酚酞的水形成的喷泉溶液显无色,C错误;
D.设烧瓶容积为VL,则烧瓶内氨气的物质的量为:n=![]() =
=![]() mol,由于氨水充满烧瓶,所以最终形成氨水的物质的量浓度c=
mol,由于氨水充满烧瓶,所以最终形成氨水的物质的量浓度c=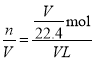 =
=![]() mol/L,D正确;
mol/L,D正确;
故合理选项是C。

 应用题作业本系列答案
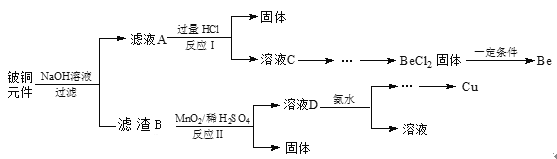
应用题作业本系列答案【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
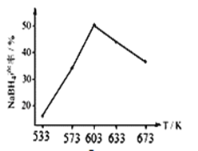
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
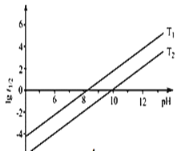
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)