题目内容
【题目】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
①NH4NO3![]() NH3↑+HNO3↑②NH4NO3
NH3↑+HNO3↑②NH4NO3![]() N2O↑+2H2O↑
N2O↑+2H2O↑
③2NH4NO3![]() 2N2↑+O2↑+4X↑④4NH4NO3
2N2↑+O2↑+4X↑④4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑
3N2↑+2NO2↑+8H2O↑
请回答下列问题:
(1)这四个反应中属于氧化还原反应的有___个。
(2)反应③中物质X的化学式是___。
(3)反应④中氧化产物和还原产物依次是___、___。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为___。
【答案】3 H2O N2 N2和NO2 5NA或者3.01×1024
【解析】
①NH4NO3![]() NH3↑+HNO3↑中元素化合价不发生改变,为非氧化还原反应;②NH4NO3
NH3↑+HNO3↑中元素化合价不发生改变,为非氧化还原反应;②NH4NO3![]() N2O↑+2H2O↑中氮元素化合价发生改变,为氧化还原反应;③2NH4NO3
N2O↑+2H2O↑中氮元素化合价发生改变,为氧化还原反应;③2NH4NO3![]() 2N2↑+O2↑+4X↑中氮、氧元素化合价发生改变,为氧化还原反应;④4NH4NO3
2N2↑+O2↑+4X↑中氮、氧元素化合价发生改变,为氧化还原反应;④4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑氮元素化合价发生改变,为氧化还原反应。
3N2↑+2NO2↑+8H2O↑氮元素化合价发生改变,为氧化还原反应。
(1)综上分析,属于氧化还原反应的有②③④,共3个。
(2)根据元素守恒,反应③中物质X的化学式是H2O。
(3)反应④4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑中氮元素化合价升高生成N2,氧化产物为N2,失电子数为[0-(-3)]
3N2↑+2NO2↑+8H2O↑中氮元素化合价升高生成N2,氧化产物为N2,失电子数为[0-(-3)]![]() 4=12,根据得失电子守恒,则氮元素化合价降低生成N2和NO2,还原产物为N2和NO2。
4=12,根据得失电子守恒,则氮元素化合价降低生成N2和NO2,还原产物为N2和NO2。
(4)标准状况下的11.2L氧气的物质的量为0.5mol,根据反应方程式2NH4NO3![]() 2N2↑+O2↑+4H2O↑可知,氧元素由-2价变为0价,氮元素由-3价、+5价变为0价,根据得失电子守恒,生成1mol氧气转移10mol电子,故生成0.5mol转移电子数为5NA或者3.01×1024。
2N2↑+O2↑+4H2O↑可知,氧元素由-2价变为0价,氮元素由-3价、+5价变为0价,根据得失电子守恒,生成1mol氧气转移10mol电子,故生成0.5mol转移电子数为5NA或者3.01×1024。

【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
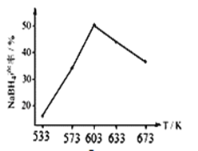
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
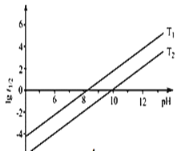
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)