题目内容
10.下表是元素周期表一部分,列出了十个元素在周期表中的位置:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程

(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
分析 依据元素周期表可知①是Na,②是K,③是Mg,④是Ca,⑤是Al,⑥是C,⑦是N,⑧是Cl,⑨是Br,⑩是Ar,
(1)原子半径比较:电子层数不同的电子层数越多半径越大;电子层相同的(同周期)质子数越多半径越小;
(2)元素金属性越强最高价氧化物对应水化物碱性最强;非金属性越强最高价氧化物对应水化物酸性越强;短周期呈两性的氢氧化物只有氢氧化铝;
(3)盐M是NH4NO3,离子化合物含离子键和共价键;
(4)③是Cl⑧是Mg二者通过得失电子形成离子化合物;
(5)元素⑥是C,设该氢化物为CxHy,根据烃的结构推出xy的数值;
(6)电解熔融的氧化铝制取铝;
(7)过氧化钠与水反应生成氢氧化钠和氧气,据此书写化学反应方程式.
解答 解:依据元素周期表可知①是Na,②是K,③是Mg,④是Ca,⑤是Al,⑥是C,⑦是N,⑧是Cl,⑨是Br,⑩是Ar,
(1)③号元素为Ca,在③-⑦中电子层最多的是④Ca,故答案为:Ca;
(2))①~⑩中非金属性最强的是⑧Cl,HClO4酸性最强,⑤Al对应的氢氧化物为Al(OH)3 具有两性,故答案为:HClO4;Al(OH)3;
(3)NH4NO3,中NH4+NO3-之间存在离子键,NH4 + 内部和NO3-内部存在N-H和N-O共价键,故答案为:离子键、共价键;
(4))③是Cl⑧是Mg二者通过得失电子形成离子化合物,形成过程为 ,故答案为:
,故答案为: ;
;
(5)设该氢化物为CxHy 则6x+y=32 根据烃的结构讨论 x=1 y=26 错;x=2 y=20错;x=3 y=14错; x=4 y=8正确;x=5 y=2错,故答案为:C4H8;
(6)工业上电解熔融的氧化铝制取铝,故答案为:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(7)过氧化钠与水反应生成氢氧化钠和氧气,化学反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查了元素周期律、元素周期表的应用、化学键类型的判断、电子式的书写、有机物分子式的推导、电解氧化铝制备铝,题目知识点多,难度中等.

| A. | ⅦA族元素是同周期中原子半径最大的元素 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | ⅦA族元素的最高正价都是+7价 | |
| D. | ⅦA族元素是同周期中非金属性最弱的元素 |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | - |
| 最低负价 | - | -1 | - | - | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | M(OH)2的碱性比XOH的碱性强 |
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
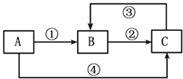 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )| A. | ①中所加试剂可能是氯气 | |
| B. | ③中需要加具有氧化性的试剂 | |
| C. | A与稀硝酸反应一定能实现元素M在①中发生的价态变化 | |
| D. | 元素M在②中发生的价态变化也能通过加碘化钾溶液实现 |