题目内容
1.硼氢化钠(NaBH4)广泛用于精细有机合成.Bayer法合成硼氢化钠流程图如下:
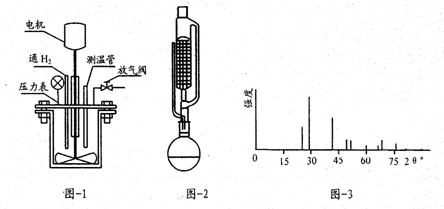
(1)“合成”时,可在图1所示的反应釜中进行.
①从煤油中取出金属钠需先用滤纸吸干,再用石油醚洗涤,其目的是除去表面的煤油.
②通氢气前需先通入氮气的目的是除去装置中的水蒸气和空气,防止原料及产品分解及氧化.
③合成反应的化学方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3.
(2)“萃取”时,可在图2中进行,该仪器名称为索氏提取器.
(3)实验中可以循环使用的位置是异丙胺;对所得产品进行分析得图3图谱,该图谱名称为X-射线衍射谱.
分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
(1)①石油醚与煤油互溶,用石油醚除去钠表面的煤油;
②NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;
钠极易和空气中氧气、和水反应;
③根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
(2)图2,该仪器是索氏提取器;
(3)将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,异丙胺又可以溶解硼氢化钠;图3是X-射线衍射谱.
解答 解:NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
(1)①石油醚与煤油互溶,用石油醚洗涤金属钠,可以除去钠表面的煤油;
故答案为:除去表面的煤油;
②NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;
钠极易和空气中氧气、和水反应;
故答案为:除去反应器中的水蒸气和空气,防止原料及产品分解及氧化;
③该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,转移电子总数为4,
根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
故答案为:NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3;
(2)图2,该仪器是索氏提取器.故答案为:索氏提取器;
(3)将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,异丙胺又可以溶解硼氢化钠;图3是X-射线衍射谱;
故答案为:异丙胺;X-射线衍射谱.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | H2O2 | B. | Na2O2 | C. | H2S | D. | Mg(NO3)2 |
 .有关柠檬烯的分析正确的是( )
.有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 它和丁基苯( )互为同分异构体 )互为同分异构体 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化反应 | |
| D. | 它的分子中所有的碳原子一定在同一个平面上 |
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
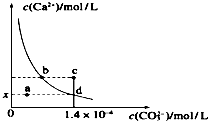 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )| A. | x的数值为2×10-5 | B. | c点时有CaCO3生成 | ||
| C. | 加入蒸馏水可使溶液由d点变成a点 | D. | b点与d点对应的溶度积相等 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程

(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| A. | 任何状态下,1molCO2和18克水所含的分子数和原子数都相等 | |
| B. | 22.4L的任何气体的物质的量为1mol | |
| C. | 非标准状况下,1mol任何气体的体积必定不是22.4L | |
| D. | 标准状况下,1molSO3的体积是22.4L |
