题目内容
15.环境中常见的重金属污染物有:汞、铅、锰、铬、镉.处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为:CrO42-$\underset{\stackrel{{H}^{+}}{→}}{①转化}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{②还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{③沉淀}$Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O.
(1)写出第①步反应的平衡常数表达式K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$
(2)关于第①步反应,下列说法正确的是AC
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.2mol Cr2O72-,需要1.2mol mol的FeSO4•7H2O.
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为Fe(OH)3.在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):
当pH调至4时,c(OH-)=10-10mol•L-1,c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=10-2mol•L-1>10-5mol•L-1,因此Cr3+没有沉淀完全.
分析 (1)反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)根据已知的反应物和生成物,结合元素守恒及电荷守恒书写离子方程式;根据得失电子守恒来计算;
(4)根据化学反应过程的分析判断离子种类,得出产物;根据溶度积常数计算,确定溶液中离子是否沉淀完全;
解答 解:(1)反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$,故答案为:K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$;
(2)A.溶液的pH值不变,即溶液的酸性不变,氢离子浓度不变,达到了化学平衡状态,故A正确;
B.只要反应发生就是非氧化还原反应,不能作平衡状态的标志,故B错误;
C.强酸性环境,溶液的颜色为橙色,说明Cr2O72-的浓度不变,达平衡状态,故C正确;
故选:AC;
(3)第②步中Cr2O72-与Fe2+反应生成Fe3+和Cr3+,其反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;根据电子得失守恒可知,还原1molCr2O72-离子得到Cr3+,得电子为2×(6-3)=6mol,需要FeSO4•7H2O的物质的量为6÷(3-2)=6mol,所以还原0.2mol Cr2O72-,需要1.2mol的FeSO4•7H2O,故答案为:1.2;
(4)根据分析③当Cr2O72-→2Cr3+变化时,溶液中产生了Cr3+的同时,又发生了Fe2+→Fe3+的过程 溶液中又产生了Fe3+,因此加入OH-又有Fe(OH)3生成;根据溶度积常数的计算,结合Cr(OH)3(s)?Cr3+(aq)+3OH(aq),当溶液的pH值调至4时,c(OH-)=1×10-10,常温下,Cr(OH)3的溶度积K sp=10-32,Ksp(Cr(OH)3)=c3(OH)•c(Cr3+),c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-32}}{1{0}^{-30}}$=10-2mol/L>10-5 mol/L,
故答案为:Fe(OH)3;当pH调至4时,c(OH-)=10-10 mol•L-1,c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=10-2 mol•L-1>10-5 mol•L-1,因此Cr3+没有沉淀完全.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程

(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| A. | Al(OH)3═Al3++3OH- | B. | KHSO4═K++H++SO${\;}_{4}^{2-}$ | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO${\;}_{4}^{-}$ |
| A. | 玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都是石灰石 | |
| B. | 钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 | |
| C. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| D. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 |
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
 .
. .
. $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O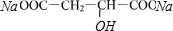 +2H2O+2CO2↑
+2H2O+2CO2↑ ,
, (或
(或 ).
).