题目内容
5.将一定量的乙烷完全燃烧,使所有的气体按顺序通过装有无水氯化钙和氢氧化钾的硬质玻璃管,氢氧化钾管的质量增加了4.4g,则乙烷在标准状况下体积( )| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
分析 C2H6完全燃烧生成CO2和H2O,使所有的气体按顺序通过装有无水氯化钙、KOH的硬质玻璃管,无水氯化钙吸收H2O、KOH吸收CO2生成K2CO3和H2O,所以KOH管增加的质量为CO2的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒得n(C2H6)=$\frac{1}{2}$n(CO2)=$\frac{1}{2}$×0.1mol0=0.05mol,根据V=nVm计算乙烷体积.
解答 解:C2H6完全燃烧生成CO2和H2O,使所有的气体按顺序通过装有无水氯化钙、KOH的硬质玻璃管,无水氯化钙吸收H2O、KOH吸收CO2生成K2CO3和H2O,所以KOH管增加的质量为CO2的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒得n(C2H6)=$\frac{1}{2}$n(CO2)=$\frac{1}{2}$×0.1mol0=0.05mol,V(C2H6)=nVm=0.05mol×22.4L/mol=1.12L,故选B.
点评 本题考查化学方程式的有关计算,侧重考查分析计算能力,明确各物质吸收的物质是解本题关键,利用原子守恒进行计算,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
13.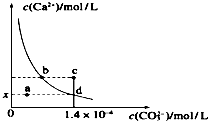 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )| A. | x的数值为2×10-5 | B. | c点时有CaCO3生成 | ||
| C. | 加入蒸馏水可使溶液由d点变成a点 | D. | b点与d点对应的溶度积相等 |
20.X、Y、Z、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、Z同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | Z、N的简单离子的还原性:Z2->N- | |
| B. | Y2X和Y2X2都是碱性氧化物 | |
| C. | Z与X形成的化合物对应的水化物一定是强酸 | |
| D. | Z元素的非金属性比N元素的非金属性强 |
10.下表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程

(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
17.S(单斜)和S(正交)是硫的两种同素异形体,下列说法正确的是,已知:
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3( )
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3( )
| A. | △H3=0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | 正交硫比单斜硫稳定 | |
| D. | 单斜硫比正交硫稳定 |
19.将标准状况下的VL HCl(气)溶于水配成1L溶液,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为( )
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |

