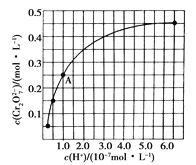
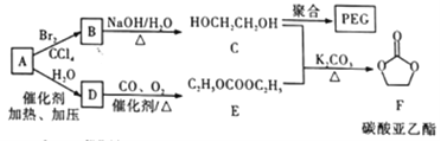
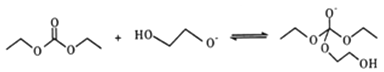
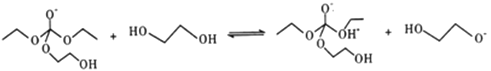
题目内容
【题目】实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg===Cu2HgI4+2Cu(反应前后的I均为-1价且产物中的汞元素为+2价)。
(1)上述反应产物Cu2HgI4中,铜元素显______价。
(2)以上反应中的氧化剂为________,还原剂为________,氧化产物是________,还原产物是________,当有2 mol CuI参与反应时,转移电子________ mol。
【答案】+1CuIHgCu2HgI4Cu1
【解析】
(1)Cu2HgI4中Hg为+2价,I为﹣1价,化合物中正负化合价的代数和为0;
(2)4CuI+Hg═Cu2HgI4+2Cu中,Hg元素的化合价升高,Cu元素的化合价降低,结合化合价变化计算转移电子。
(1)Cu2HgI4中Hg为+2价,I为﹣1价,则Cu元素的化合价为[0﹣(+2)﹣(﹣1)×4]×![]() =+1,
=+1,
故答案为:+1;
(2)4CuI+Hg═Cu2HgI4+2Cu中,Hg元素的化合价升高,则还原剂为Hg,氧化产物为Cu2HgI4,Cu元素的化合价降低,氧化剂为CuI,还原产物为Cu,当有2mol CuI参与反应时,只有一半作氧化剂,转移电子为1mol×(1﹣0)=1mol,
故答案为:CuI;Hg;Cu2HgI4;Cu;1.

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置____________,从元素原子得失电子的角度看,元素④具有____________性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性__________(写氢化物的化学式);
(3)元素⑦的原子结构示意图是____________;
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”、“放热”)反应;
(5)元素⑨与⑤形成的化合物高温下灼烧该时,火焰呈________色;
(6)用电子式分别表示表示下列元素的单质反应得到的化合物的形成过程:
①与④:___________________________;
⑤与⑦:___________________________。