题目内容
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)![]() (绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是________________________;
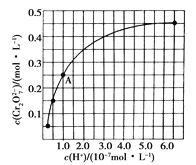
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如上图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应_____________________;
②由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________;
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示滴定终点的到达。当溶液中Cl-恰好沉淀完全(Cl-浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO![]() )等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为_______________________________________。
【答案】 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 2CrO42-+2H+Cr2O72-+H2O 增大 1.0×1014 小于 2.0×10-5 5.0×10-3 Cr2O72-+3HSO3-+5H+===2Cr3++3SO![]() +4H2O
+4H2O
【解析】试题分析:(1)根据题给信息知在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
(2)①根据图像知随着氢离子浓度的增大,Na2CrO4溶液中CrO42-转化为Cr2O72-,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
②由图可知,溶液酸性增大,Cr2O72-的浓度逐渐增大,CrO42的平衡转化率增大。根据A点数据知,Cr2O72-的浓度为0.25mol/L,CrO42-的浓度c(CrO42)=0.5mol/L;H+浓度为1×10-7mol/L;此时该转化反应的平衡常数为K=c(Cr2O72-)/ c2(CrO42)c2(H+)= 1.0×1014。
③由于升高温度,溶液中CrO42的平衡转化率减小,说明升高温度,化学平衡逆向移动,导致溶液中CrO42的平衡转化率减小,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故该反应的ΔH<0;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×105mol·L1,根据溶度积常数Ksp(AgCl)=2.0×1010,可得溶液中c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×1010÷(1.0×105mol·L1)=2.0×10-5mol·L1;则此时溶液中c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×1012÷(2.0×10-5)2=5×10-3mol·L1。
(4)NaHSO3具有还原性,Cr2O72具有氧化性,二者会发生氧化还原反应,根据已知条件,结合电子守恒、电荷守恒、原子守恒,可得二者反应的离子方程式为Cr2O72+3HSO3+5H+==2Cr3++3SO42+4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
【题目】大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对雾霾的成分进行了验证,并测定空气中SO2的含量及探究H2SO3的部分性质。
回答下列问题:
(1)硫酸铵是某地PM2.5雾霾的主要成分,收集一定量的雾霾固体进行验证。
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份盛于试管中:
操作步骤 | 实验现象 | 结论 |
①向其中一份_______ | 有白色沉淀生成 | 证明雾霾固体中含有SO42- |
②向另一份中_____,用镊子夹持湿润的红色石蕊试纸靠近试管口 | ③试管中有气泡产生,___________________ | 证明雾霾固体中含有NH4+。综合上面实验,初步说明雾霾固休颗粒中含有(NH4)2SO4 |
(2)用如图所示简易装置测定空气中SO2的含量。
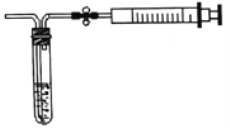
①测定原理:SO2通入碘的淀粉溶液中,使溶液由蓝色变为无色,反应的化学方程式为______。
②测定方法:在某监测点,量取5.0mL5.0×10-4mol/L的碘溶液,注入图中的试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8000.0mL,则测得该监测点空气中SO2的含量为_____mg/L。
(3)探究H2SO3的部分性质。
选用下面的装置和药品探究H2SO3与HClO的酸性强弱
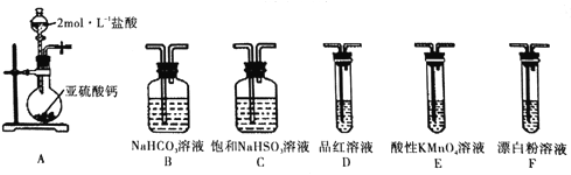
①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明H2SO3与HClO的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学采用间接法证明,实验方案为:按照A→C____(其字母) →尾气处理顺序连接装置,其中装置C的作用是___________;证明H2SO3的酸性强于HClO的酸性的实验现象是_____。