题目内容
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
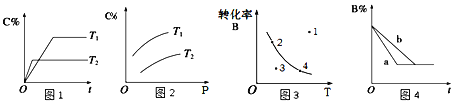
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】A. 由图1可知,T2时达到平衡所需时间短,所以T1<T2,升温平衡左移,该反应正反应为放热反应,故A错误;B. 由图2可知,加压平衡右移,说明该反应m+n>p,故B错误;C. 图3中,温度一定,点3达到平衡的过程中B减少,V正>V逆,故C正确;D. 图4中,若m+n=p,加压平衡不移动,则a曲线可能为加压,故D错误。故选C。
点睛:在分析本题图1和图4一类涉及影响反应速率条件的图像时,注意把握图像的关键内容—斜线的斜率,斜率越大,反应速率越大,对应的是有利于增大反应速率的条件。
【题型】单选题
【结束】
11
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)![]() 3Z(g)+Q(s) △H >0,下列叙述正确的是
3Z(g)+Q(s) △H >0,下列叙述正确的是
A. 当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B. 达到平衡时X的转化率为25%,则平衡常数K值为9/4
C. 达到平衡后,反应速率2V正(Y)="3" V逆(Z)
D. 达到平衡后,加入Q,平衡逆向移动
【答案】B
【解析】试题分析:A.当容器中X与Y的物质的量的比满足1:2时,并不一定是物质的量不变的状态,所以反应不一定达到平衡,A错误;B.设起始时X和Y的物质的量浓度都为1mol/L,则
X(g)+2Y(g)![]() 3Z(g)+Q(s)
3Z(g)+Q(s)
初起量(mol) 1 1 0
变化量(mol) 0.25 0.5 0.75
状态1(mol) 0.75 0.5 0.75
Kc=0.753÷(0.75×0.52=9/4,所以平衡常数K值为9/4,B正确;C.达到平衡后,反应速率3V正(Y)="2" V逆(Z),不是2V正(Y)="3" V逆(Z),C错误;D.到平衡后,加入Q,Q是固体,平衡不移动,D错误;答案选B。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案