题目内容
18.根据下列某些短周期元素的性质回答问题.| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3_(写化学式).
(3)某元素R的原子半径为1.02×10-10m,它与钠形成Na2R2,其电子式是
 _(R用元素符号表示).
_(R用元素符号表示).(4)元素①和⑨形成阳离子,其结构式为
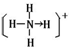 ,含有的化学键类型共价键、配位键.
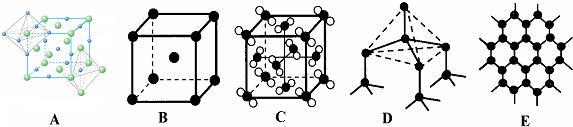
,含有的化学键类型共价键、配位键.(5)元素②和⑦形成晶体的部分结构可用下图中的A_来表示(填序号).
分析 短周期元素中,元素①、②和⑧,最高正价为+1价,处于IA族,原子半径①<⑧<②,且故①为H,②为Na,⑧为Li;⑥和⑨的最高正价为+5,最低负价为-3,且原子半径⑥>⑨,故⑥为P,⑨为N;⑦、⑩都有最低负价为-1,⑦有最高正价为+7,⑩没有正化合价,故⑦为Cl、⑩为F;⑤有最高价+4、最低价-4,处于ⅣA族,原子半径大于N,小于Cl,故⑤为C;③有最低-2,没有最高正化合价,原子半径小于N,故③为O;④有最高价+3,处于ⅢA族,原子半径大于P,故④为Al,据此解答.
解答 解:短周期元素中,元素①、②和⑧,最高正价为+1价,处于IA族,原子半径①<⑧<②,且故①为H,②为Na,⑧为Li;⑥和⑨的最高正价为+5,最低负价为-3,且原子半径⑥>⑨,故⑥为P,⑨为N;⑦、⑩都有最低负价为-1,⑦有最高正价为+7,⑩没有正化合价,故⑦为Cl、⑩为F;⑤有最高价+4、最低价-4,处于ⅣA族,原子半径大于N,小于Cl,故⑤为C;③有最低-2,没有最高正化合价,原子半径小于N,故③为O;④有最高价+3,处于ⅢA族,原子半径大于P,故④为Al.
(1)①为氢,②为钠,⑧为锂,元素的非金属性越强,第一电离能越大,同主族自上而下第一电离能减小,故第一电离能的大小顺序为:H>Li>Na;
③、⑥和⑨的氢化物分别为:H2O、PH3、NH3,由于氨气分子间能形成氢键,故NH3>PH3,水分子之间存在氢键,常温下水为液态,氨气为气体,水的沸点最高,故沸点高低顺序为:H2O>NH3>PH3,
故答案为:H>Li>Na;H2O>NH3>PH3;
(2)元素C、P和Cl的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3,
故答案为:CCl4、PCl3;
(3)某元素R的原子半径为1.02×10-10m,介于Cl、P之间,它与钠形成Na2R2,故R为S元素,Na2S2与过氧化钠的结构类似,其电子式为: ,
,
故答案为: ;
;
(4)元素①、⑨形成的阳离子为NH4+,含有共价键、配位键,铵根离子的结构式为: ,故答案为:
,故答案为: ;共价键、配位键;
;共价键、配位键;
(4)元素②和⑦形成晶体为NaCl,属于离子化合物,其晶胞结构中每个钠离子周围有6个氯离子、每个氯离子周围有6个钠离子,A图符合其结构,故答案为:A.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意识记中学常见晶胞结构,难度中等.

| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
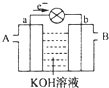 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )| A. | a电极发生还原反应,b电极发生氧化反应 | |
| B. | a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O | |
| C. | A处通入的是空气,B处通入的是CO | |
| D. | 用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L |
| 品名 | 苏打饼干 |
| 配料 | 面料、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、苏打 |
| 保质期 | 12个月 |
| 生产日期 | 2015年5月15日 |
| A. | 精炼食用植物油能使溴水和酸性KMnO4溶液褪色 | |
| B. | 白砂糖属于二糖,在人体内水解而转化为单糖 | |
| C. | 鲜鸡蛋清遇浓硝酸变为黄色 | |
| D. | 奶油与白砂糖都是高分子化合物 |
| 元素编号 | 元素性质或原子结构 |
| X | 形成的简单阳离子核外无电子 |
| Y | 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应 |
| Z | 元素在周期表的族序数等于周期序数的3倍 |
| T | 同周期元素中形成的简单离子半径最小 |
| A. | 原子半径大小顺序:T>Z>Y>X | |
| B. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气 | |
| C. | X分别与Y、Z均可形成既含极性键又含非极性键的化合物 | |
| D. | 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用 |
| A. | 可充电的电池称“二次电池”,在充电时,是将电能装化为化学能,在放电时,又将化学能转化为电能 | |
| B. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| A. | CH3CH2CH2CH3 | B. | 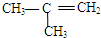 | C. | 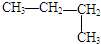 | D. | CH3-CH=CH2 |
| A. | 反应后剩余气体的成分是碳酸钠和氢氧化钠 | |
| B. | 原来混合气体中甲烷和氧气的体积比2:1 | |
| C. | 原来混合气体中甲烷与氧气的体积比为1:2 | |
| D. | 原来的密闭容器中,甲烷、氧气、过氧化钠的物质的量之比为2:1:6 |
| A. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | CH2=CH(CH3)C=CH2 2-甲基-1,3-二丁烯 | |
| C. | CH2(OH)CH2CH2CH2OH 1,4-二羟基丁醇 | |
| D. | CH3CH2CHClCCl2CH3 2,2,3-三氯戊烷 |