题目内容
2.下列各组物质互为同分异构体的是( )| A. | 苯甲醇和甲基苯苯酚 | B. | 乙醇和乙醚 | ||
| C. | 丁二烯和2-丁烯 | D. | 乙醇和乙二醇 |
分析 A.苯甲醇和甲苯酚是分子式相同结构不同的化合物;
B.乙醇和乙醚分子式分别为C2H6O、C4H10O;
C.丁二烯和2-丁烯分子式分别为C4H6、C4H8;
D.乙醇和乙二醇分子式分别为:C2H6O、C2H6O2.
解答 解:A.苯甲醇和甲苯酚是分子式相同结构不同的化合物,所以属于同分异构体,故A正确;
B.乙醇和乙醚分子式分别为C2H6O、C4H10O,分子式不相同,故B错误;
C.丁二烯和2-丁烯分子式分别为C4H6、C4H8,分子式不相同,故C错误;
D.乙醇和乙二醇分子式分别为:C2H6O、C2H6O2,分子式不相同,故D错误.
故选A.
点评 本题考查了有机化合物的同分异构体的判断和理解,掌握概念实质是解题关键,题目较简单.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
12.下列现象中,是因为发生加成反应而产生的现象是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
13.下列能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
17.具有如下电子排布的原子,其相应元素一定属于同一主族的是( )
| A. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| B. | 2p轨道上有2个未成对电子的原子和3p轨道上有2个未成对电子的原子 | |
| C. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| D. | 电子排布式为1s2的原子和外围电子排布式为2s22p6的原子 |
7.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式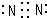 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅣA族.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
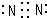 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅣA族.
14.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的要求 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代常用的一次性饭盒,可防止产生白色污染 | |
| C. | 蛋白质、淀粉、纤维素这些生活中的常见物质都是天然高分子化合物 | |
| D. | 煤经气化和液化两个物理过程,可变为清洁能源 |
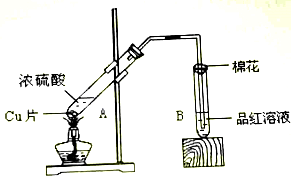
 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答: