题目内容
5.沪昆高铁在新化洋溪建了一个新化南站,方便了新化及周边县市人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3,下列说法正确的是( )| A. | Al元素被还原 | |
| B. | Al2O3是氧化产物 | |
| C. | Fe2O3既是氧化剂又是还原剂 | |
| D. | 每生成1molFe时,转移电子的物质的量为3mol |
分析 A.得电子化合价降低的元素被还原;
B.失电子化合价升高的反应物是还原剂,生成氧化产物;
C.该反应中Fe元素化合价由+3价变为0价,得电子化合价降低的反应物是氧化剂;
D.转移电子的物质的量=化合价变化×物质的量;
解答 解:A.该反应中Fe元素化合价由+3价变为0价,所以Fe元素被还原,故A错误;
B.该反应中Al元素化合价由0价变为+3价,所以Al是还原剂、Al2O3是氧化产物,故B正确;
C.该反应中Fe元素化合价由+3价变为0价,所以Fe2O3是氧化剂,故C错误;
D.该反应中Fe元素化合价由+3价变为0价,所以每生成1molFe时,转移电子的物质的量=3×1mol=3mol,故D正确;
故选BD.
点评 本题考查氧化还原反应,侧重考查基本概念,明确元素化合价与物质性质关系是解本题关键,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
13.下列能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
20.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
17.具有如下电子排布的原子,其相应元素一定属于同一主族的是( )
| A. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| B. | 2p轨道上有2个未成对电子的原子和3p轨道上有2个未成对电子的原子 | |
| C. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| D. | 电子排布式为1s2的原子和外围电子排布式为2s22p6的原子 |
14.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的要求 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代常用的一次性饭盒,可防止产生白色污染 | |
| C. | 蛋白质、淀粉、纤维素这些生活中的常见物质都是天然高分子化合物 | |
| D. | 煤经气化和液化两个物理过程,可变为清洁能源 |
15.己烯雌酚是一种激素类药物,结构如图,下列有关叙述中正确的是( )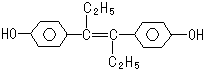

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
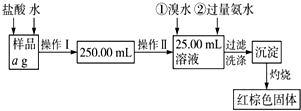 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题: