题目内容
7. 西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题:
西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题:(1)电极A的电极反应:2H++2e-=H2↑;
(2)电解饱和食盐水的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)电解所用的盐水需精制.去除有影响的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,精制流程如下:
称取粗盐$\stackrel{溶解}{→}$$→_{①}^{BaCl_{2}}$$→_{②}^{NaOH}$$→_{③}^{Na_{2}CO_{3}}$$→_{④}^{过滤}$滤液$→_{⑤}^{适量盐酸}$$→_{⑥}^{蒸发、结晶、烘干}$精盐
①在除杂过程中,所加试剂应该过量,以保证除尽杂质.第③步中,相关的离子方程式是Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓.
②若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是在此酸度条件下会有部分沉淀溶解,从而影响制得精盐的纯度.
分析 (1)钠离子向阴极移动,所以A是阴极,阴极水电离产生的氢离子发生还原反应,所以电极反应式为:2H++2e-=H2↑;
(2)电解饱和食盐水生成氢气、氯气和氢氧化钠,所以离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)①碳酸钠可以除去两种杂质:钡离子和钙离子;
②氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,据此回答.
解答 解:(1)钠离子向阴极移动,所以A是阴极,阴极水电离产生的氢离子发生还原反应,所以电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)电解饱和食盐水生成氢气、氯气和氢氧化钠,所以离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)①加入碳酸钠的目的是除去溶液中氯化钙以及先前加入的氯化钡,故离子反应方程式为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓;
②若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
点评 本题是一道物质的电解池的工作原理和分离和提纯的方法和基本操作的综合应用题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
17.判断下列化合物的化学键的类型,并根据化学键类型归类化合物类型;
| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
18.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表有7个主族和8个副族 | B. | ⅣA族的元素全部是非金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期指第1、2周期 |
15.下列关于化学反应限度的说法中正确的是( )
| A. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| B. | 化学反应的限度不可以通过改变条件而改变 | |
| C. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| D. | 当一个可逆反应达到平衡状态时,那么这个反应的正反应速率和逆反应速率为零 |
2.下列事实不能用电化学理论解释的是( )
| A. | 镁片不用特殊方法保存 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 轮船水线以下的船壳上装一定数量的锌块以保护船体 | |
| D. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
19.除去NaCl固体中的NH4Cl的最佳方法是( )
| A. | 利用溶解度不同,采用结晶法 | B. | 直接加热法 | ||
| C. | 加入烧碱 | D. | 加入AgNO3溶液 |
16.下列变化属于吸热反应的是( )
| A. | 将胆矾加热变成白色粉末 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | 干冰升华 | D. | 生石灰与水反应生成熟石灰 |
17.下表中关于物质分类的正确组合是( )
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C |
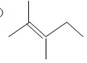
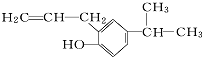 的分子式为C12H16O.
的分子式为C12H16O. 分子中至少有11个碳原子处于同一平面上.
分子中至少有11个碳原子处于同一平面上.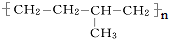 的单体为
的单体为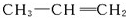 和
和 .
.