题目内容
【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
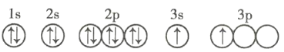
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。
【答案】原子的2p轨道半充满,能量低,稳定 -1 F的电负性大,只能得电子 2 能量最低原则 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】
由题干信息推知R为N元素,S为F元素,T为Sc元素,X为Mg元素。
(1)R元素基态原子的轨道表示式可表示为![]() ;R为氮元素,氮原子2p轨道半充满,能量低,稳定,所以其第一电离能比同一周期相邻的碳元素、氧元素要大;
;R为氮元素,氮原子2p轨道半充满,能量低,稳定,所以其第一电离能比同一周期相邻的碳元素、氧元素要大;
(2)由题中信息可知S为氟元素,其电负性大,只能得电子,无正价,其常见化合价为-1
(3)基态T原子的核外电子排布式为![]() ,N电子层上只有2个电子
,N电子层上只有2个电子
(4)3s轨道电子未排满,X的轨道表示式违背了能量最低原则;燃放时,焰火发出五颜六色的光,电子从能量较高的轨道跃迁到能量较低的轨道时以光子的形式释放能量,所以可以做成烟火。

练习册系列答案
相关题目