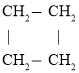题目内容
【题目】某温度下,向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸(C6H5COOH,弱酸)溶液,溶液的pH和pOH[pOH=-lgc(OH-)]关系如图所示。
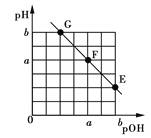
下列说法正确的是
A.在该温度下,0.1 mol·L-1 NaOH溶液的pH=2a+1
B.F点对应苯甲酸溶液体积V=20.00 mL
C.在G与F之间某点对应的溶液中水的电离程度最大
D.温度不变,加水稀释E点溶液,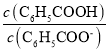 增大
增大
【答案】C
【解析】
向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸,反应是逐步进行的,氢氧化钠溶液先变为氢氧化钠和苯甲酸钠混合溶液,再变为苯甲酸钠溶液,进而变为苯甲酸钠和苯甲酸混合溶液,溶液由碱性变为中性,再变为酸性。由图可知,G点溶液显碱性,F点为中性溶液,E点溶液显酸性,该温度下,水的离子积常数Kw为10—2a。
(1)0.1 mol·L-1 NaOH溶液中c(OH—)为0.1 mol·L-1,由F点可知水的离子积常数Kw为10—2a,则溶液中c(H+)为10—2a+1,则pH为2a—1,A错误;F点为中性溶液,是苯甲酸和苯甲酸钠的混合溶液,所以F点对应苯甲酸溶液体积V大于20.00 mL,B错误;苯甲酸和氢氧化钠溶液恰好反应生成苯甲酸钠溶液时,水的电离程度最大,恰好反应点在G与F之间,C正确;E点为苯甲酸钠和苯甲酸混合溶液,溶液显酸性,加水稀释时,苯甲酸的电离平衡右移,n(C6H5COOH)减小,n(C6H5COO—)增大,则![]() 减小,D错误。
减小,D错误。
故选C。

【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
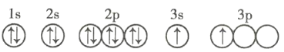
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。
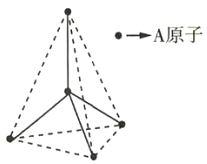
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp1 | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
【题目】有机物的结构可用键线式表示,如:
结构简式 |
|
|
|
键线式 |
|
|
|
(1)![]() 的分子式为___________。
的分子式为___________。
(2)已知三个乙炔分子反应生成苯,试写出三个丙炔分子反应生成的芳香烃分子的键线式:__________(填一种即可)。
(3)由![]() 以及必要的无机试剂可合成
以及必要的无机试剂可合成 ,写出第一步合成反应的化学方程式:________。
,写出第一步合成反应的化学方程式:________。
(4)A为![]() 的一种同分异构体,A的一氯代物有三种,且A与
的一种同分异构体,A的一氯代物有三种,且A与![]() 按物质的量之比为
按物质的量之比为![]() 加成得到的产物只有一种(不考虑顺反、立体异构),则A可能的结构简式有_____________。
加成得到的产物只有一种(不考虑顺反、立体异构),则A可能的结构简式有_____________。