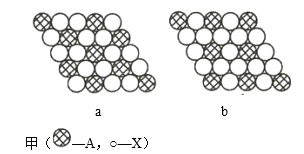题目内容
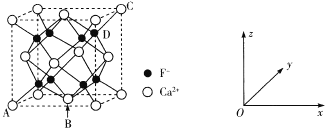
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
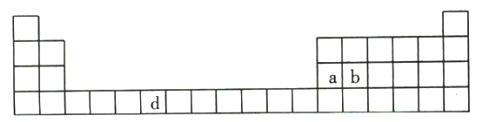
(1)请写出元素d的基态原子的电子排布式: _______________________________________。
(2)b的氧化物中b原子与氧原子之间的共价键类型是__________________________其中b原子的杂化方式是____________________________________________。
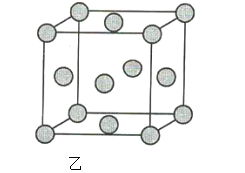
(3)a的单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
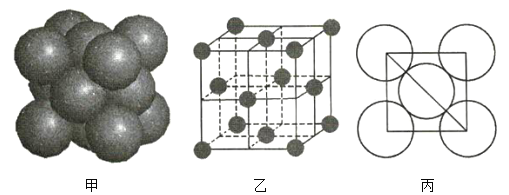
若已知a元素原子的半径为d,NA代表阿伏加德罗常数,a元素原子的摩尔质量为M,则1个晶胞中a原子的数目为____________________________,该晶体的密度为____________________________________(用字母表示)。
【答案】1s22s22p63s23p63d54s1或[Ar]3d54s1 ![]() 键(或极性共价键) sp3杂化 4
键(或极性共价键) sp3杂化 4 ![]()
【解析】
(1)根据d在元素周期表中的位置可知,元素d为Cr,其d轨道半充满时更稳定,Cr的基态原子的电子排布式是1s22s22p63s23p63d54s1。(2)SiO2中Si与相邻的4个O形成正四面体结构,其中Si的杂化方式是sp3杂化。(3)1个晶胞中a原子的数目为![]() ;该晶胞的质量m=4×
;该晶胞的质量m=4×![]() ,该晶胞的体积
,该晶胞的体积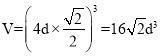 ,则晶胞密度
,则晶胞密度![]() 。
。

 名校课堂系列答案
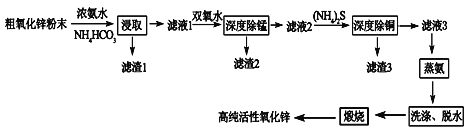
名校课堂系列答案【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______
【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
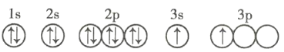
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。